而发布路径诱导信息的主要方式则是通过设置于上游重要节点处的VMS 发布前方的拥堵路段,令前往拥堵路段方向的出行者提前作出适当的选择。......
2025-09-30
2.1 大菱鲆有丝分裂雌核发育规模化诱导
2025年度,采用单因子实验对真鲷冷冻精子诱导大菱鲆有丝分裂雌核发育的试验条件(处理起始时刻、压力和持续时间)进行了摸索和优化,观察了各实验组的胚胎发育过程,统计了各实验组的受精率和孵化率,根据所观察的单倍体、杂交、杂交加倍胚胎发育结果和雌核发育仔鱼倍性检测结果,有丝分裂雌核发育诱导率达100%,但所有试验组孵化率最高仅为4.43%,加大了规模化诱导和苗种培育的难度。全年春季和冬季2个繁殖季节共进行5次大菱鲆有丝分裂雌核发育规模化诱导试验,春季共获得初孵仔鱼12 000尾,目前保有6月龄有丝分裂雌核发育苗种4尾(性别暂时未检测),冬季共获得初孵仔鱼46 000尾,现正进行苗种培育。
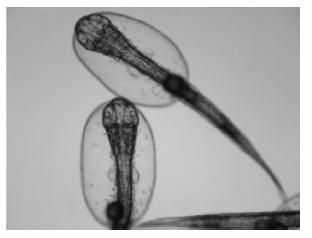
图9 有丝分裂初孵仔鱼
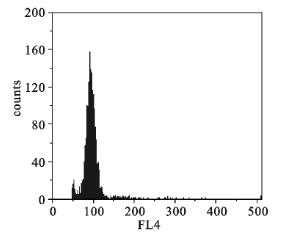
图10 雌核发育仔鱼流式细胞倍性鉴定结果
2.2 大菱鲆四倍体规模化诱导
2025年度在进行有丝分裂雌核发育诱导的同时,还对大菱鲆四倍体诱导条件进行了试验和摸索,同时采用NORs-Ag染法等对四倍体诱导率进行综合评价。2025年冬季在对春季所探索的四倍体诱导条件优化的基础上,规模化诱导大菱鲆四倍体2批次,分别获得初孵仔鱼72 000尾和80 000尾,经NORs-Ag染法统计,得到30尾正常体型的初孵仔鱼,其四倍体诱导率为61.67%,现正进行苗种培育,其四倍体成活率、生长率将跟踪检测。
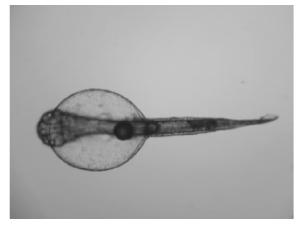
图11 四倍体初孵仔鱼
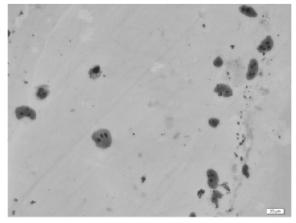
图12 NORs-Ag染法显示的四倍体初孵仔鱼
2.3 大菱鲆有丝分裂型和减数分裂型雌核发育诱导的比较研究
有丝分裂型雌核发育是抑制第一次卵裂完成二倍体化,有时又称为纯合子或同质雌核发育。其两套染色体来源于雌核染色体组的复制,每一对同源染色体中的一条是以另一条为模板如实复制得到,其遗传组成从理论上来讲是完全相同的,其所有基因座位都是纯合的,可以直接用于建立纯系。下一代如重复进行有丝分裂,雌核发育便形成克隆品系(Cloned fish),而减数分裂雌核发育因其保留的第二极体中的染色体在第一次减数分裂时发生了交换重组,因此不能得到纯系。有丝分裂型雌核发育二倍体比减数分裂型雌核发育二倍体的研究价值要大得多,但诱导成功率也比后者低得多。
表16 大菱鲆有丝分裂型和减数分裂型雌核发育的诱导比较
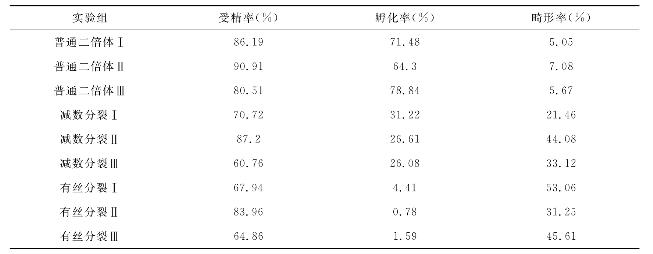
本实验采用来源于3尾不同亲鱼的未受精卵分别进行正常受精(普通二倍体)、冷休克抑制第二极体释放获减数分裂型雌核发育、静水压抑制第一次卵裂获有丝分裂型雌核发育,比较2种类型雌核发育的诱导效果。结果表明,2种雌核发育孵化率均显著低于普通二倍体,初孵仔鱼畸形率则显著高于普通二倍体,其中,有丝分裂型雌核发育和减数分裂型雌核发育受精率差异均不显著,但前者孵化率仅有0.78%~4.41%,又显著低于减数分裂型雌核发育(26.08%~31.22%),这可能与静水压力对受精卵造成的机械损伤较冷休克大有关,也与有丝分裂型雌核发育子代基因高度纯合,使致死基因表达概率升高有关。
2.4 大菱鲆有丝分裂型雌核发育、四倍体胚胎发育时序比较
实验于2025年5月在烟台开发区天源水产有限公司进行,大菱鲆为养殖场光、温调控性成熟的亲鱼。真鲷冷冻精液由本体系苗种繁育岗位研究团队惠赠(中国科学院海洋研究所精子冷冻保存),于-180℃液氮中保存。大菱鲆产卵水温11.8℃±0.2℃,人工挤卵,干法人工授精。受精及孵化用深井海水依次经沙滤、曝气、紫外消毒、充氧等处理,受精水温14.5℃,处理前孵化水温为14.5℃±0.5℃,处理后直接置于11.8℃±0.2℃水温中孵化,孵化期间海水pH为7.8~8.2,盐度为29.7。大菱鲆胚胎发育采用显微镜(Nikon E200)观察,佳能数码相机拍摄不同发育阶段的照片。
2.4.1 各实验组的胚胎处理方法
普通二倍体胚胎:大菱鲆精子与卵子人工干法受精而得,作为对照组;
减数分裂型雌核发育胚胎:由紫外线照射后的真鲷冷冻精液激活大菱鲆卵子,经冷休克处理抑制第二极体释放而得;
有丝分裂型雌核发育胚胎:由紫外线照射后的真鲷冷冻精液激活大菱鲆卵子,经静水压处理抑制第一次卵裂而得;
四倍体胚胎:大菱鲆精子与卵子人工干法授精,经静水压处理抑制第一次卵裂而得;杂交四倍体:真鲷冷冻精液与大菱鲆卵子人工干法授精,经静水压处理抑制第一次卵裂而得。
2.4.2 胚胎发育过程
在亲鱼产卵水温为11.8℃±0.2℃,受精水温14.5℃,各实验组处理前孵化水温为14.5℃±0.5℃,处理后孵化水温为11.8℃±0.2℃的条件下,各实验组胚胎发育时序见下表,具体发育过程如下:
2.4.2.1 卵裂期
大菱鲆受精卵直径为1.02mm±0.04mm,油球径为0.13mm±0.06mm(n=30)。各试验组的胚胎发育首先在动物极形成胚盘,并开始均等分裂,经过2细胞、4细胞、8细胞、16细胞、32细胞、64细胞,进入多细胞期,细胞数量继续增加,呈桑葚状,进入桑葚胚期。卵裂期,各试验组胚胎发育形态基本相似,但各处理组均有一定比例的非规则分裂细胞存在,尤其杂交四倍体组为多;但细胞分裂速度不同,各处理实验组明显慢于对照组(普通二倍体),冷休克的减数分裂组较静水压处理的各实验组稍快,发育速度依次为普通二倍体>减数分裂组>四倍体组>有丝分裂组和杂交组(两者间发育速度近乎一致)。
2.4.2.2 囊胚期
胚盘高矗于动物极,呈圆面包状,明显突出于卵黄上,中央有囊胚腔,处于高囊胚期;囊胚细胞继续分裂,胚盘高度逐步下降,边沿向外扩展,与卵黄囊交界处坡度渐变平缓,而进入低囊胚期。此期,除杂交加倍组的囊胚帽均形态不整外,静水压处理的有丝分裂组和四倍体组均有大量受精卵呈现囊胚冒形态不圆滑现象,而冷休克组囊胚帽形态则没有异常,发育速度排序与卵裂期一致。
2.4.2.3 原肠期(https://www.chuimin.cn)
原肠初期,细胞由胚盘中心向边沿流动,胚盘四周边缘的细胞越积越多,经外包与内卷而形成胚环;胚盘下包至1/5时,由胚环某处加厚部分形成的胚盾明显突出,即为胚体原基,进入原肠中期;胚盘下包1/3时,胚体初现;胚盘下包1/2时,胚体向前延伸,而达原肠后期。此期,普通二倍体、减数分裂组形态上没有明显差异;有丝分裂组和四倍体组有大量受精卵胚盘四周边缘不整齐,卵下沉比例增加;杂交加倍组细胞内卷受阻,胚盘边缘极度不规则,胚环结构不明显,胚盘表面凸凹不平,细胞排列稀疏,呈现多个空洞的形态,胚盘下包速度正常,卵开始大量下沉;发育速度同上。
2.4.2.4 神经胚期
胚盘继续下包,胚体不断延伸,胚盘下包至2/3时,头突出现;胚盘下包3/4~4/5时,头部明显扩大,听囊亦扩大,头的两侧突出一对眼囊。此期,普通二倍体组、减数分裂组和四倍体组受精卵发育形态均无明显差别,只是四倍体有少量胚盘表面细胞排列不够紧密、存有空洞、胚体不清晰的现象;有丝分裂组仍有大批受精卵胚盘表面细胞排列不够紧密、有空洞、胚体不清晰的现象,但也存在一定比例的正常个体;杂交四倍体组胚盘下包速度未受阻,但全部受精卵胚盘表面细胞排列较有丝分裂组尚为稀疏,表面空洞极大,胚体也不清晰。各组发育速度排序与原肠期一致,但四倍体组胚盘下包速度似乎开始加快,逐渐与减数分裂组相近。
2.4.2.5 克氏囊期
胚体绕卵黄1/2,原口关闭,此时在胚体末端或近末端处出现一个或数个透明小泡,即为克氏囊,亦称克氏囊期。杂交四倍体组胚体十分模糊,未观察到克氏囊。发育速度依次为普通二倍体>四倍体组>减数分裂组>有丝分裂组和杂交组。
2.4.2.6 卵黄栓期
胚盘继续下包至卵黄另一端,收缩成一个圆孔,即为原口,原口内的卵黄栓显露而为卵黄栓期。此阶段,杂交四倍体组胚体均十分模糊,胚体四周散落大量细胞;有丝分裂组较其余组畸形胚体数目明显较多。发育速度依次为普通二倍体>四倍体组>减数分裂组>有丝分裂组>杂交组。
2.4.2.7 尾芽期
原口关闭后,随着胚胎发育,肌节清晰可见,在原口关闭处胚体末端向外伸展出现尾芽,即为尾芽期。杂交四倍体组尾芽可见,但受精卵再次出现大量下沉,仅余不足10%的受精卵;有丝分裂组和四倍体组畸形胚体四周分散一些空泡状物质,推测为细胞。此期胚胎发育速度排序仍与前面保持一致。
2.4.2.8 晶体期
围心腔形成;尾部与卵黄分离,尾形成;肌节明显;视囊内晶体出现而达晶体期。此期可显著观察到有丝分裂组和四倍体组畸形胚体数量较多,呈现两种形态,一是胚体模糊,不成形,二是头突不完整,周围散落很多零碎细胞团,集中于头部;杂交四倍体仅余少量卵,各器官发育十分不明显,至出膜期全部死亡。此期,除杂交四倍体组外,发育速度依次为普通二倍体>四倍体组>减数分裂组>有丝分裂组。
2.4.2.9 心跳期
胚体绕卵黄3/4,心跳初现,尾延长,耳石形成,胚体两侧浅棕色色素增多,胚体开始间歇扭动。至此,杂交四倍体组仅残余个别漂浮卵,其胚体模糊,各器官发育不明显;统计各实验组105h时心跳次数,依次为普通二倍体30次/分钟、四倍体组22次/分钟、减数分裂组20次/分钟、有丝分裂组15次/分钟。
2.4.2.10 出膜前期
胚体绕卵黄4/5,尾部继续延长,背鳍褶前部及尾鳍褶中部出现浅棕色色素丛,心跳加快,胚胎扭动频繁,即将出膜。在出膜前期,有丝分裂组和四倍体组下沉卵比例明显高于另外2组,胚体畸形率也要高于其他2组。各组发育速度排序与前期一致。
2.4.2.11 出膜期
初孵仔鱼正在出膜,体色透明,背、臀、尾鳍褶上的色素丛明显。有丝分裂组和四倍体组初孵仔鱼畸形率显著高于减数分裂组,减数分裂组则显著高于普通二倍体组,畸形初孵仔鱼主要表现为2种,一种是胚体明显粗短、骨骼弯曲,另外一种则是胚体长度基本正常但骨骼弯曲明显;四倍体较普通二倍体的孵化出膜时间滞后5h左右,减数分裂组滞后约9h,有丝分裂组滞后约12h。
表17 各试验组大菱鲆胚胎发育时序
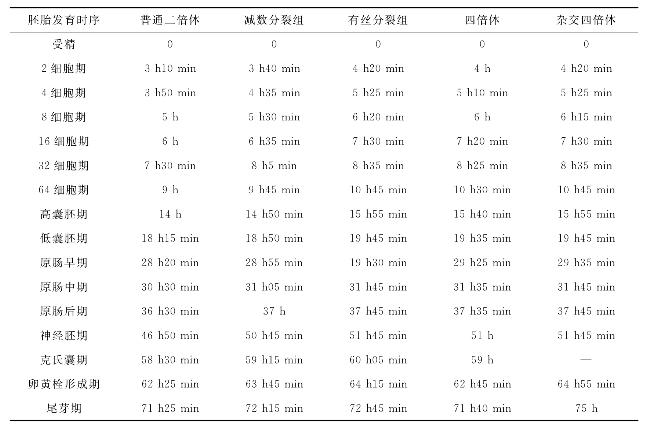
(续表)

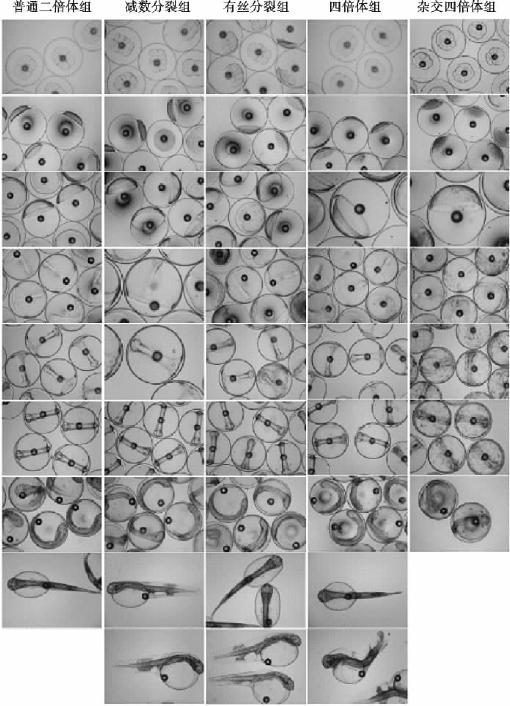
图13 大菱鲆有丝分裂雌核发育二倍体和四倍体胚胎发育过程
2.5 大菱鲆生殖细胞减数分裂标记基因的克隆及表达分析
鱼类早期性别决定表现为生殖细胞的分化,而生殖细胞的分化始于减数分裂的启动,因此准确判断减数分裂启动时期是阐明其性别决定机制的基础。传统上确定鱼类早期性别分化的方法主要基于组织学的研究结果,包括两个方面:解剖学上卵巢腔或输精管的出现和细胞学上性母细胞的出现,但两者都是早期性别分化的表现结果而不是真正的起点,在相应分化标志出现之前,生殖细胞的性别决定即减数分裂就已开始。目前对模式鱼类斑马鱼、青鳉的研究证实,早在卵巢的组织分化完成以前,雌性生殖细胞的减数分裂已经开始,据此确定2种鱼类的性别分化起始时期为初孵仔鱼。以大菱鲆为例,卵巢分化的组织学出现时期为45日龄(全长37.4mm),但是采用高温对不同初始规格的大菱鲆进行温度诱导性反转的试验则表明,高温可以显著诱导起始规格为10~30mm(20~40日龄)的大菱鲆稚鱼的雄性化,从实验生态学的角度证实了大菱鲆生殖细胞性别分化的起始时间要早于组织学的分化。因此,对大菱鲆生殖细胞几种减数分裂标记基因的克隆及表达分析的研究有助于明确其性别分化的起始时间和调控机制,通过对该时期基因表达谱的研究,将有助于发掘其性别决定和分化的控制基因,从而阐明其性别决定机制。通过设计基因特异性引物,以雌雄大菱鲆幼鱼性腺cDNA为模板,克隆获得scp3、figla、spo11、dmc1基因片段序列,对PCR产物进行回收、连接、转化、克隆测序,所得片段序列以BLASTn在NCBI数据库中进行序列比对,确认所扩增片段为目的基因。
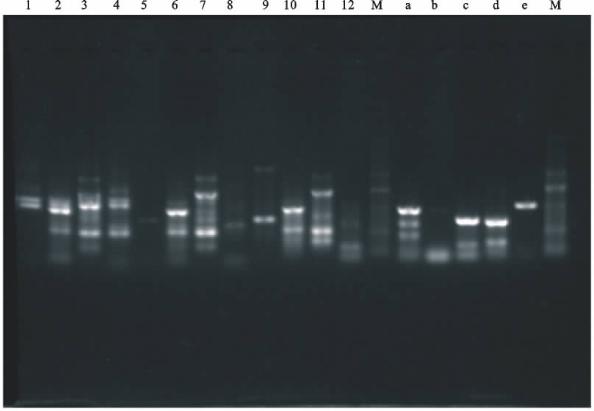
图14 不同组合兼并引物扩增的spo11(1~12)和figla(a~e)基因片段
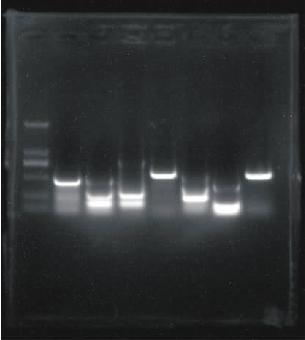
图15 不同组合兼并引物扩增的scp3目的条带
(岗位专家 刘海金)
相关文章

而发布路径诱导信息的主要方式则是通过设置于上游重要节点处的VMS 发布前方的拥堵路段,令前往拥堵路段方向的出行者提前作出适当的选择。......
2025-09-30

激光诱导式细胞打印技术的原理是利用激光束对细胞的作用力沉积细胞。当激光束对细胞的作用力大于10pN[3],可使细胞在几十微米至几毫米的范围内移动,进而使细胞沉积并成形。激光发射脉冲时,光能通过透明基体并由激光吸收层吸收,导致下方细胞悬浮液中的细胞射向接收基体并在此基体上形成细胞图形。激光诱导细胞打印技术的主要问题是打印的效率较低,液滴的产生速率仅为100滴/s,不适于高效率地在体外构建人体的组织或器官。......
2025-09-29

A.指示B.吸收能量C.标识公路用地界限D.减轻事故车辆及人员的损伤程度E.诱导视线2.下列交通安全设施中,能诱导视线的有()。A.警告标志 B.指示标志C.指令标志 D.提示标志E.旅游区标志4.下列交通安全设施中,属于交通标线构成部分的有()。喷涂标线时,应用交通安全措施,设置适当警告标志,阻止车辆及行人在作业区内通行,防止将涂料带出或形成车辙,直至标线充分干燥。......
2025-09-30

研究结果表明,氮离子束对3份二倍体水稻材料的效应因材料种类和离子注入剂量不同而异。试验材料经过离子束注入处理后在生化培养箱内用清水浸泡48h,再催芽24h。在染色体组多倍化的试验中,以3份经过离子注入的二倍体水稻及其对照为研究材料,按照种芽诱导法进行染色体组多倍化诱导[3]。......
2025-09-30

肯普佛特考察了真正的工业时代,社会所普遍采用的发明基本上来自于各个规模大小不等的公司,公司雇用大量的训练有素的专业人员进行系统的发明活动。发明的产生从早期的个人逐渐转向公司的团体发明人员,公司的团体发明人员在各个领域将多项发明同时进行研究,以满足社会实际使用的需要,技术发展由此进入一个大规模发明时期。......
2025-09-30

表9分型成功的7个SNP位点信息及基因注释信息图12小片段法基因分析部分结果2.4大菱鲆转录组高通量测序工作基于当前大菱鲆遗传育种工作的深入开展,需要筛选出大量的分子标记,构建高密度遗传连锁图谱,从而根据重要的经济性状,进行QTL定位,实现传统育种与分子辅助育种技术的结合;并开展与选育性状相关的功能基因研究。......
2025-09-30

差别仅仅在于纺丝溶液制备部分的设备,目前之所以投资高的原因是Lyocell纤维的专用设备尚未形成批量生产。随着新上项目的不断增多,一旦投入批量生产,逐步形成具有一定规模的专业设备制造厂,设备制造成本将会有较大幅度的下降。因此,Lyocell纤维投资成本要达到黏胶设备的水平是完全有可能的,当然,实现这一目标需要有一定的时间。Lyocell纤维要增加其性价比开发品种将是一个重要的方向。......
2025-09-29

实验表明,这些致癌植物中所含有的“病毒早期抗原诱导物”,可以诱导EB病毒对淋巴细胞的转化,并能促进由肿瘤病毒或化学致癌物质引起的肿瘤生长。目前,致癌植物诱发鼻咽癌和食管癌的实验已得到证实,它们不仅浑身上下都带“毒”,而且种过此类植物的土壤中都被检测出含有致癌病毒和化学致癌物的激活物质。所以鼻咽癌素有“广东癌”之称。曾毅说,鼻咽癌在广东地区高发,主要还是饮食习惯和接触促癌物质有关。......
2025-09-30
相关推荐