第二篇关于同源四倍体水稻的诱导文献综述根据进化论的观点,植物物种的形成和分化要经过漫长的历程,而不同物种在演化过程中所经历的艰难程度都大不相同。其二,在种子露白时进行诱导处理只能使胚芽鞘明显膨大而不能从其后代中筛选到四倍体材料;先行预处理,使胚芽鞘伸长到2.0cm左右时再用秋水仙素对种芽进行诱导处理则能从其后代中筛选到四倍体材料。......
2023-11-28
黄群策 李玉峰 余增亮
摘要 利用3份二倍体水稻为材料,以氮离子束为诱变源,研究了离子注入后所引起的生物学效应和离子注入对水稻多倍化的效果。研究结果表明,氮离子束对3份二倍体水稻材料的效应因材料种类和离子注入剂量不同而异。N+注入处理后对利用秋水仙素诱导水稻多倍化的效果比较明显,但效果的明显程度则因离子注入剂量不同或秋水仙素诱导时间不同或试验材料的遗传背景不同而表现出一定的差异。在秋水仙素对试验材料的诱导时间为24h的各个处理中,N+离子注入剂量为6.76×1016N+/cm2的处理似乎更好,而在秋水仙素对试验材料的诱导时间为48h的各个处理中,N+离子注入剂量为0.52×1016N+/cm2的处理则更有利于获得同源四倍体材料。经过2~3个世代的筛选之后并通过染色体核型分析,在试验材料的后代中已经获得了一些同源四倍体水稻材料。
关键词 氮离子注入;秋水仙素;同源四倍体水稻;诱导效果
随着我国超级杂交稻育种已经取得突破性进展和超级杂交稻在生产上的成功应用,以挖掘产量潜力为育种目标的水稻遗传改良的水平已经达到了相当高的程度。在此产量基础上,试图进一步提高水稻的单位面积产量则需要寻找新的育种思路和开辟新的育种途径。根据普通栽培稻(Oryza sativa)在遗传上的特点、生物学特性、光合代谢功能、产量潜力和生殖发育特点,近年来一些研究者提出通过染色体组多倍化在多倍性水平进一步挖掘水稻杂种优势效应的育种设想[1,2]。为了更深入地研究多倍体水稻的潜在利用价值,迫切需要获得各种各样的或具有不同遗传基础的多倍体水稻材料。特别值得注意的是,这项探索性研究是否能取得突破性进展在很大程度上取决于我们是否能在近期内获得大量的带有不同遗传背景和具有潜在利用价值的多倍体水稻材料。然而,以传统的种芽诱导法来获得多倍体水稻的效率很低,以至于很难满足水稻多倍体育种的需要,由此促使研究者们急需寻找新的诱导方法,以便更高效地获得多倍体材料[3]。在20世纪80年代中期兴起的离子束生物技术,在创造生物体遗传性变异群体方面具有新颖性,即离子束作为新的诱变源具有质量、能量、电荷三位一体的功效,它对生物体的作用主要表现为促使细胞内容物发生原子位移、重组和化合。在操作过程中,注入离子的数量可以调节,注入离子的射程可以控制。在损伤比较轻的诱变状态中,可以获得比较高的诱变率和比较宽的诱变谱,其实用性和普遍性已经被大量的实验结果所证实[4,5]。根据离子束对生物体具有一定的遗传性变异效应这一特点,我们以经过离子注入处理的水稻种子为材料,以秋水仙素为诱变源进行多倍化诱导试验,试图借助于低能离子束的生物学效应提高将二倍体水稻诱导成同源四倍体水稻的效率,为水稻多倍化诱导寻找到新的研究方法。
1 材料和方法
在离子注入的试验中以3份二倍体水稻(IR36、紫血稻和多胚苗品系APⅣ)为研究材料。本试验设3次重复,每份材料的每一次处理包括500粒种子,在评估试验效果时以3次重复的平均值为依据分析离子注入的生物学效应。首先将每份水稻种子去壳,经过表面消毒后将其插入并固定在盛有花泥的培养皿中。种子的胚部露在花泥的外面(即种胚朝上露出),以便能直接受到氮离子束的照射。在工作真空度为10-6Pa的条件下每份材料所接受的照射剂量依实验设计不同而异。在氮离子注入时采用间隔为50 s的脉冲注入,在真空靶室内氮离子束的能量为25 keV,采用9种不同的注入剂量。注入剂量的范围为0.52×1016~8.84×1016N+/cm2,每个处理组之间的间隔剂量为1.04×1016N+/cm2。同时,每份材料均设置对照,对照材料同样被放置在真空靶室内但不经过离子束注入处理。试验材料经过离子束注入处理后在生化培养箱(35℃条件)内用清水浸泡48h,再催芽24h。然后,将其消毒灭菌后接种到盛有MS培养基的培养瓶内进行培养(培养温度为26℃,每天照光时间为10h,光照强度为2 000 Lx)。经过10 d时间的培养后统计每份试验材料的存活率和发芽率。
在染色体组多倍化的试验中,以3份经过离子注入的二倍体水稻(IR36、紫血稻和多胚苗品系APⅣ)及其对照为研究材料,按照种芽诱导法进行染色体组多倍化诱导[3]。根据离子注入试验中所获得的研究结果,在对试验材料进行离子注入和多倍化诱导时选择2个离子注入剂量,即0.52×1016N+/cm2(设为N+处理剂量Ⅰ)和6.76×1016N+/cm2(设为N+处理剂量Ⅱ)。首先将各份经过离子注入的种子在生化培养箱(35 ±1)℃条件内,用自来水浸泡48h,接着进行24h摧芽。当种子露白时在淹水条件下进行96h暗培养,以便促进种子的胚芽鞘快速伸长并抑制种根的生长。待试验材料的胚芽销伸长至2.0cm左右时,分别用浓度为0.04%的秋水仙素水溶液浸泡24h、48h、72h和96h。然后,试验材料经过消毒灭菌后接种到盛有1/2mS培养基内进行培养(培养温度为26℃,每天照光时间为10h,光照强度为2 000 Lx)。当试验材料生长到二叶一心时被移入大田,让其在自然条件下生长发育。根据各处理材料中成活植株的外部形态(如植株形态、茎叶的粗壮程度、生育期长短、种子粒型大小、种子顶部芒的有无、稻穗的着粒密度和结实率高低等性状)对其进行初步筛选,各单株材料分收分种。经过2~3个世代的筛选后确定其染色体组的倍性水平。
对于经过2~3个世代筛选后从外观性状被确定为多倍体的水稻材料,还要根据前人的研究方法[6]对其细胞内的染色体数目进行鉴定。具体的鉴定方法是,以各个单株的种根根尖为试验材料,首先用饱和对二氯苯水溶液预处理3h,清洗后将其置于卡诺氏固定液中固定5h,Feulgen染色,酷酸洋红压片后进行染色体计数和染色体核型分析,由此确定同源四倍体水稻的植株数。
2 结果与分析
2.1 氮离子注入后试验材料的生物学效应
通过氮离子注入后试验中表现出明显的生物学效应,试验材料的存活率因材料类型不同而异,同一材料的存活率也与注入离子的剂量呈现出一定的相关性。尽管不同材料在试验中的变化规律不同,但变化趋势却很相似。研究结果表明,当氮离子注入剂量为0.52×1016N+/cm2时,试验材料的萌发率和存活率比相应对照的萌发率和存活率均高一些,这说明在离子注入的刺激下种子的萌发能力和成苗率有所提高。当氮离子注入剂量在0.52×1016~5.72×1016N+/cm2时,试验材料的萌发率和存活率随着离子剂量的增大而降低,氮离子注入剂量在5.72×1016N+/cm2时达到最低值。当氮离子注入剂量增大到6.76×1016N+/cm2时,试验材料的萌发率和存活率出现异常提高的非正常现象。当氮离子注入剂量继续增加时,试验材料的萌发率和存活率发生骤降,而当氮离子注入剂量为8.84×1016N+/cm2时,各份试验材料均不能萌发,没有获得成活植株(图1)。由此可见,本试验中的的2个离子注入剂量,即0.52×1016N+/cm2和6.76×1016N+/cm2所引起的生物学效应值得注意。

图1 氮离子注入后3种水稻材料的存活率变化曲线
2.2 同源四倍体水稻材料的诱导效果
根据在离子注入试验中所获得的研究结果,在对试验材料进行离子注入和多倍化诱导时我们选择了2个氮离子注入剂量,即0.52×1016N+/cm2(设为N+处理剂量Ⅰ)和6.76×1016N+/cm2(设为N+处理剂量Ⅱ)作为本试验的剂量处理,因为前者具有生物学的刺激作用而后者表现出生物学的修复效应。
在N+处理剂量Ⅰ的试验中,如果秋水仙素处理时间为24h,与对照相比较,被处理材料的种子死芽数比较少而种芽成活率和成苗率则比较高,但在种子胚芽鞘膨大数和同源四倍体植株数上并没有表现出明显的差异。如果秋水仙素处理时间为48h,被处理材料与对照在种子死芽数、种芽成活率和成苗率上表现出明显的差异,不但被处理材料的成活率有所提高而致死率比较低,并且在其后代群体内筛选到比较多的同源四倍体单株(3份材料IR36、紫血稻和多胚苗品系APⅣ中分别筛选出7株、9株和5株同源四倍体植株,而在对照材料中所筛选出的同源四倍体植株分别为5株、6株和4株)。如果秋水仙素处理时间为72h,被处理材料与对照在种子死芽数、种芽成活率和成苗率上所表现出的差异也很明显,被处理材料的成活率要高于对照的成活率,在其后代群体内筛选到更多的同源四倍体单株(3份材料IR36、紫血稻和多胚苗品系APⅣ中分别筛选出36株、36株和30株同源四倍体植株,而在对照材料中所筛选出的同源四倍体植株分别为31株、30株和25株)。从这些研究结果可以看出,在N+处理剂量Ⅰ的试验中尽管注入氮离子的剂量不足以引起试验材料发生明显的变异,但由于离子束的生物学刺激作用而促进了秋水仙素对试验材料进行染色体组多倍化的效果(表1-N+TreatmentⅠ)。
表1 N+注入后对试验材料多倍化的诱导效果
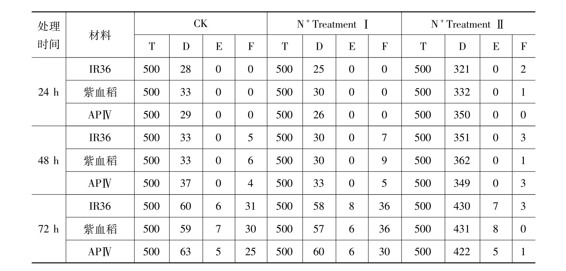
注: T—总粒数,D—死芽数,E—胚芽鞘膨大数,F—同源四倍体植株数(www.chuimin.cn)
在N+处理剂量Ⅱ的试验中,实验材料的死芽数明显增加,这很可能是离子注入后所导致的生物学效应。秋水仙素对实验材料的处理时间无论是24h还是48h或72h,其种子死芽数明显地多于对照的死芽数,而在种芽成活率和成苗率上前者明显地低于后者。从处理后的筛选效果来看,当秋水仙素处理时间为24h时在IR36和紫血稻群体中分别筛选到2株和1株同源四倍体材料(在N+处理剂量Ⅰ和对照中均没有获得同源四倍体材料)。然而,从秋水仙素对实验材料的处理时间为48h或72h的实验结果来看,这一剂量的离子注入似乎对染色体组多倍化的作用表现出明显的负效应,因为由此筛选到的同源四倍体材料的数量明显地减少(表1-N+TreatmentⅡ)。
本实验的研究结果表明,N+注入处理后对利用秋水仙素诱导水稻多倍化的效果比较明显,但效果的明显程度则因离子注入剂量不同或秋水仙素诱导时间不同或试验材料的遗传背景不同而表现出一定的差异。秋水仙素对试验材料的诱导时间为24h的各个处理中,N+离子注入剂量为6.76×1016N+/cm2的处理似乎更好,而在秋水仙素对试验材料的诱导时间为48h的各个处理中,N+离子注入剂量为0.52×1016N+/cm2的处理则更有利于获得同源四倍体材料。由此可见,离子注入有助于提高诱导多倍体水稻材料的效果,这主要是由于离子注入的诱变作用或刺激作用所致。
2.3 同源四倍体水稻材料的鉴定和筛选
在诱导材料的当代群体内对材料的筛选可以根据其植株的形态特点和种子粒形大小进行。一般而言,植株比较矮壮、生育期比较长、叶片宽大、叶色深绿、种子粒形大、种子顶部有短芒或长芒以及结实率明显偏低的植株有可能是已经发生了染色体组多倍化的植株,但这样的植株大多数是遗传上的嵌合体,即植物体组织中的各个细胞所具有的染色体组倍性并不是完全一致,有些是二倍性细胞而另一些是多倍性细胞(图2)。在诱导当代群体内所筛选到的具有同源四倍体外部形态特征的植株在下一个世代群体内会出现比较明显的性状分离现象(图3)。我们到目前为止尚未在诱导当代群体内筛选到遗传上稳定而在下一个世代性状不会发生分离的同源四倍体水稻材料。然而,对大部分的诱导材料而言,经过2~3个世代的筛选和纯化之后就可以获得性状比较稳定的多倍体材料;对少部分的诱导材料而言,经过2~3个世代的筛选和纯化之后很难获得性状比较稳定的多倍体材料,其性状分离的时间比较长,个别材料甚至经过10~12个世代还是难以稳定。
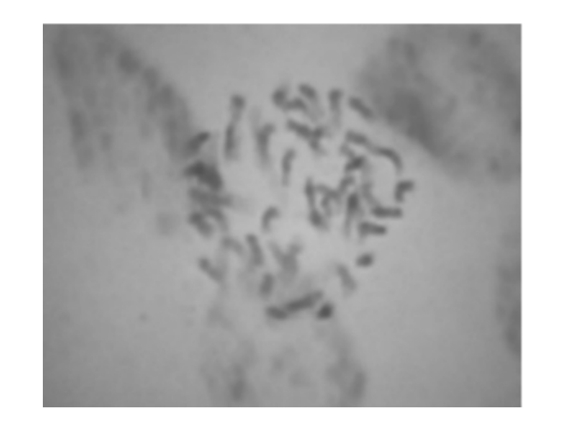
图2 同源四倍体水稻染色体核型

图3 同源四倍体与相应的二倍体水稻的粒型
3 讨论
在超级杂交水稻已经取得突破性研究进展的前提下试图进一步挖掘水稻的产量潜力则在很大程度上依赖于我们是否能在水稻遗传改良领域利用现代生物技术寻找到新的突破口和建立新的技术体系。在多倍体水平研究水稻的潜在价值和探索利用其杂种优势效应的可能性将有助于在稻属植物内寻找到进一步挖掘水稻增产潜力的新途径。关于多倍体水稻的特征特性,前人已经进行过一些研究和探索,但多倍体水稻材料在数量上的局限性导致了许多研究者对多倍体水稻的潜在价值还没有清醒的认识,以至于常常用传统的稻作学观念看待在多倍体水稻研究中所出现的问题。目前多倍体水稻材料在数量上的局限性主要是由于水稻染色体组多倍化的诱导效果并不好,其技术还有待于进一步完善。根据离子束生物技术的特点,利用离子束作为一种诱变源提高秋水仙素诱导水稻多倍化的效果则值得研究。在本试验中我们利用3份二倍体水稻品系为材料,以氮离子束为诱变源,研究了离子注入后所引起的生物学效应和离子注入对水稻多倍化的效果。本试验的研究结果表明,氮离子束对3份二倍体水稻材料的效应因材料种类和离子注入剂量不同而异。在试验中发现,N+注入处理后对利用秋水仙素诱导水稻多倍化的效果比较明显,但效果的明显程度则因离子注入剂量不同或秋水仙素诱导时间不同或试验材料的遗传背景不同而表现出一定的差异。秋水仙素对试验材料的诱导时间为24h的各个处理中,N+离子注入剂量为6.76×1016N+/cm2的处理似乎更好,而在秋水仙素对试验材料的诱导时间为48h的各个处理中,N+离子注入剂量为0.52×1016N+/cm2的处理则更有利于获得同源四倍体材料。由此可见,离子注入有助于提高诱导多倍体水稻材料的效果,这主要是由于离子注入的诱变作用或刺激作用所致。除此之外,经过2~3个世代的筛选之后并通过染色体核型分析,在试验中已经获得了一些同源四倍体水稻材料。值得特别指出的是,在水稻多倍化诱导试验中借助于离子注入技术试图提高多倍体诱导频率的实用性问题还值得进一步研究和探讨。
[1]蔡得田,袁隆平,卢兴桂.二十一世纪水稻育种新战略Ⅱ利用远缘杂交和多倍体双重优势进行超级稻育种[J].作物学报,2001,27(1):110-116.
[2]黄群策,孙梅元,邓启云.同源四倍体水稻的潜在价值研究[J].杂交水稻,2001,16(1):1-3.
[3]黄群策,孙敬三,朱生伟.种芽诱导获得同源四倍体水稻的技术[J].中国农学通报,1997,3(6):21-23.
[4]余增亮.离子束生物技术引论[M].合肥:安徽科学技术出版社,1998.
[5]黄群策,梁秋霞,李玉峰,等.低能离子注入同源四倍体水稻的生物学效应[J].激光生物学报,2003,12(5):355-359.
[6]孙敬三,钱迎倩.植物细胞学研究方法[M].北京:科学出版社,1987.
【注释】
(1)该文曾在《激光生物学报》 [2006,15(2):118~122]刊出
有关水稻染色体组多倍化研究的文章

第二篇关于同源四倍体水稻的诱导文献综述根据进化论的观点,植物物种的形成和分化要经过漫长的历程,而不同物种在演化过程中所经历的艰难程度都大不相同。其二,在种子露白时进行诱导处理只能使胚芽鞘明显膨大而不能从其后代中筛选到四倍体材料;先行预处理,使胚芽鞘伸长到2.0cm左右时再用秋水仙素对种芽进行诱导处理则能从其后代中筛选到四倍体材料。......
2023-11-28

稻属植物的进化特点及其潜在价值黄群策王书玉张书艮摘要概括了稻属植物的种群特征及进化特点。关键词稻属植物;种群特征;进化特点;染色体组多倍化;产量潜力在植物物种的自然演化进程中,稻是一种起源比较早、进化程度比较高的古老植物类群。稻属植物是禾本科中非常重要的植物种群,在该属内包含有23个物种,它们广泛分布于全球的热带地区和亚热带地区。......
2023-11-28

在当前水稻超高产育种中多倍体水稻及其潜在价值有待于进一步探讨。因此,在水稻远缘杂交中获得异源多倍体水稻的技术还有待于进一步探索。2同源四倍体水稻在水稻新种质创造中的意义近年来水稻单位面积产量一直徘徊不前,现有的水稻品种和杂交水稻组合的抗性减弱,增产潜力有限,其主要原因之一在于可供水稻育种的优良种质资源不足,亲缘重叠现象很明显。......
2023-11-28

黄群策等[6]以低能氮离子束为诱变源对同源四倍体水稻进行了遗传改良,在其后代群体内筛选到具有双胚苗特征的新材料为了对同源四倍体双胚苗突变水稻进行有效的遗传改良,郑州大学离子束生物工程河南省重点实验室的研究人员利用无性系诱导技术对其脱分化和再分化特性进行了初步研究,试图为在细胞工程水平研究同源四倍体水稻双胚苗材料的细胞学特性提供技术资料。......
2023-11-28

同源四倍体双胚苗材料在其性状表达特征、性状表达频率和性状表达的条件等方面均显现出一定的特异性。在同源四倍体双胚苗材料中,其苗位特征表现出明显的多样性。对于同源四倍体水稻群体内所出现的双胚苗突变材料,按照单株筛选法对其进行2个世代的筛选和纯化,待其主要农艺性状稳定后按照试验设计对其双胚苗的形态特征及其性状稳定性进行了研究。......
2023-11-28

我国超级稻育种的技术性突破促使稻属遗传改良的水平提升到新的研究层次并给水稻生产带来了革命性的巨变。通过现代生物技术进一步挖掘稻属植物的增产潜力和提高遗传改良水平已经成为水稻育种中的研究热点[7]。其二,在水稻遗传改良的研究领域内研究范围的局限性明显地限制着这一学科在挖掘稻属植物杂种优势效应上发生根本性突破。......
2023-11-28

关于多倍体水稻的诱导技术前人已经进行过一些研究[7,8],而关于水稻多倍化的诱导效果与其原始材料的关系的研究目前尚未见到公开的文献报道。对每份材料中所获得的同源四倍体水稻植株的数量进行统计分析,计算多倍化的诱导效果。由此可见,利用常规水稻品种和光温敏核不育水稻品系为诱导材料,其多倍化的诱导频率均很低。利用杂种F1群体为试验材料经过多倍化诱导和筛选后所获得的......
2023-11-28

研究结果表明,不同倍性的普通栽培稻与非洲栽培稻之间不存在严格的生殖隔离,通过有性杂交可以获得杂种第一代种子,但其结实率因普通栽培稻的倍性水平而异。由此认为,利用同源四倍体水稻为杂交母本与非洲栽培稻杂交更容易将后者的遗传物质引入到亚洲栽培稻。以同源四倍体水稻为杂交母本,以非洲栽培稻为花粉供体所配制的16个杂交组合均表现出明显的营养生长优势。......
2023-11-28
相关推荐