表1-12 淡水中主要无机络合物表1-13列举了25℃、1.01×105Pa条件下,天然水中主要无机离子缔合体的稳定常数。表1-13 天然水体中主要无机离子缔合体的稳定常数表1-14列举了海水中主要离子缔合体组成。这是因为它们属硬酸离子,且海水中的浓度远高于与其络合的阴离子的浓度。而、及的情况则不同,只有相应数量的阴离子与阳离子结合。压力对离子缔合体生成的影响可以根据摩尔体积估算。......
2023-06-30
Ca2+、Mg2+、Na+、K+、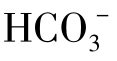 、
、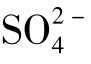 、Cl-、NO3是天然水中含量最多的8种离子,它们的含量占天然水中离子总量的95%~99%。天然水中的H+含量虽微小,但对其他元素在水环境中的迁移有巨大影响。
、Cl-、NO3是天然水中含量最多的8种离子,它们的含量占天然水中离子总量的95%~99%。天然水中的H+含量虽微小,但对其他元素在水环境中的迁移有巨大影响。
1.钙(Ca2+)
钙(Ca2+)是大多数天然淡水的主要阳离子。钙广泛分布于地表水中,其浓度一般较低。如广泛分布于地表中的钙长石(CaAl2Si2O8),其水解过程:
当水与长石的接触时间较长时,由于pH升高,可以使Ca2+从溶液中沉淀出来。
钙的存在形式主要是方解石和文石,当有Mg2+同时存在时生成白云石。其中,方解石的溶解是天然水中Ca2+的主要来源:
式(1-63)中的平衡常数+Kpso可以根据CaCO3的溶度积常数(Ksp)、碳酸的第一级和第二级离解常数K1和K2,以及CO2的亨利常数KH而求得:
各常数所代表的反应式为:
对式(1-63)而言,在电中性条件下,可以近似地认为:
将式(1-69)代入式(1-63):
将式(1-70)变形得:
同理,当水溶解白云石CaMg(CO3)2达到平衡时,可得下列方程式:
由式(1-71)和式(1-72)可知,当天然水溶解方解石或白云石时,水中Ca2+、Mg2+的含量随大气中CO2分压(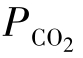 )的增加而增加,与CO2分压的立方根成正比。
)的增加而增加,与CO2分压的立方根成正比。
在没有其他溶质存在时,25℃条件下,CO2分压与方解石溶解关系如图1-20所示。图1-20表明,在正常大气中,当水与方解石接触时,水中Ca2+的含量为20mg/L。利用热力学数据计算的结果为[Ca2+]=16mg/L。主要原因是由于土壤空气中的CO2分压比地面大气高10~100倍。因此地下水中Ca2+的浓度一般比地表水的高。
方解石溶解过程中所生成的Ca2+与 含量的关系如图1-21所示。将实测数据与图1-21相比较,可以迅速地估计出Ca2+是否饱和。
含量的关系如图1-21所示。将实测数据与图1-21相比较,可以迅速地估计出Ca2+是否饱和。
图1-20 方解石在水中的溶解度(25℃)
图1-21 方解石饱和溶液中pH与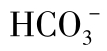 和Ca2+的关系
和Ca2+的关系
当天然水中含有较多的H+时,强酸性水对CaCO3的溶解,使水中的Ca2+大大超过与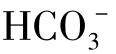 的浓度,在水与石膏或无水石膏接触时,水中的Ca2+可达到相当高的浓度;当水中只有Ca2+与
的浓度,在水与石膏或无水石膏接触时,水中的Ca2+可达到相当高的浓度;当水中只有Ca2+与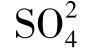 而无其他离子存在时,Ca2+的浓度可达到600mg/L。
而无其他离子存在时,Ca2+的浓度可达到600mg/L。
溶液的离子强度增大将增加水中Ca2+的平衡浓度,如当水中有2500mg/L的Cl-和1500mg/L的Na+存在时,则Ca2+与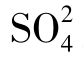 的平衡浓度可达700mg/L,这主要是由于盐效应的影响。
的平衡浓度可达700mg/L,这主要是由于盐效应的影响。
关于天然水中钙的存在形态,由于Ca2+具有相当大的离子半径(0.099nm),因此其电场强度远不如离子半径较小的二价Mg2+离子。Ca2+在水中难以生成较强的水化膜,故通常把水中的溶解态钙简单地表示为Ca2+。
Ca2+能与某些有机阴离子生成络合物,但其数量很有限,在某些水中Ca2+与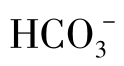 可以生成
可以生成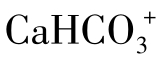 离子对,当水中
离子对,当水中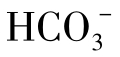 含量接近于1000mg/L时有10%的Ca2+与
含量接近于1000mg/L时有10%的Ca2+与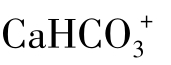 离子,CaHCO3+离子对具有较大的数量。当水中
离子,CaHCO3+离子对具有较大的数量。当水中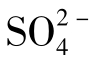 的含量超过1000mg/L时,可有一半以上的Ca2+生成CaSO4。OH-、
的含量超过1000mg/L时,可有一半以上的Ca2+生成CaSO4。OH-、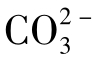 也可与Ca2+生成离子对,这种情况主要出现在强碱性溶液中。Ca2+也可与
也可与Ca2+生成离子对,这种情况主要出现在强碱性溶液中。Ca2+也可与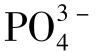 生成离子对,但在天然水中没有太大意义。
生成离子对,但在天然水中没有太大意义。
不同条件下天然水中钙的含量差别很大。在潮湿地区的河水中Ca2+的含量比其他任何阳离子的含量都高,为20mg/L左右,不超过与方解石平衡时的浓度;干旱区河水中,有较高的Ca2+含量,地下水中Ca2+的含量大于地表水中Ca2+的含量。
2.镁(Mg2+)
人们常有一种错觉,认为在天然水中镁(Mg2+)的行为与Ca2+类似,造成这种错觉的主要原因是由于两者都是水中硬度的主要物质。事实上Mg2+的化学行为与Ca2+有很大差别,由于Mg2+的离子半径比Ca2+和Na+小,具有较强的电荷密度,对水分子有更大的吸引力。
水中Mg2+周围有较厚的水膜,水化的Mg2+表示为Mg·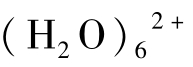 ,习惯性简写为Mg2+。在水溶液中,每个Mg2+的周围有6个水分子,其水化膜远比Ca2+和Na+厚。
,习惯性简写为Mg2+。在水溶液中,每个Mg2+的周围有6个水分子,其水化膜远比Ca2+和Na+厚。
Mg2+可以生成羟基络合物Mg(OH)+,但在pH<10时意义不大。镁的化合物中通常含有水或氢氧化物,这与其水化倾向有关。
MgCO3的溶解度关系比CaCO3复杂,因为MgCO3与羟基碳酸镁有各种不同的形态,其溶解度有较大的差别。菱镁石的溶解度是方解石的 3倍左右,而水化羟基菱镁石[Mg4(CO3)3(OH)2·3H2O]的溶解度最小。白云石的溶度积为10-19.33,地下水与白云石关系所计算的离子溶度积接近3×10-17.8。
正常大气中的CO2分压下白云石比方解石易溶,在与白云石接触的饱和与不饱和的水中,Ca2+与Mg2+几乎是等量的。而在过饱和情况下,由于CaCO3沉淀,使水中Mg2+的浓度大于Ca2+。
Mg2+存在于所有的天然水中,并且其含量仅次于Na+。但一般很少见到以Mg2+为主要阳离子的天然水(淡水中阳离子通常以Ca2+为主;咸水中阳离子以Na+为主)。在大多数水中Mg2+的含量为1~40mg/L。天然水中Ca2+与Mg2+的含量有一定的比例关系,在溶解性固体总量低于500mg/L的水中,Ca2+与Mg2+摩尔比值变化范围较大,从4∶1到2∶1,当水中溶解性固体总量大于1000mg/L时,其比值在2∶1到1∶1之间。而当水中溶解性固体总量进一步增大时,Mg2+就要超过Ca2+很多倍。淡水中Ca2+显著多于Mg2+,这是由于地壳中钙的丰度大于镁,而在咸水中Mg2+的含量大于Ca2+,是由于镁的氯化物和硫酸盐的溶解度较钙的溶解度高很多的原因。
MgSO4离子对的稳定性同CaSO4,Mg2+与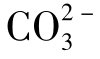 和
和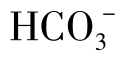 生成的络合物与Ca2+的同类络合物相近,但一般要在
生成的络合物与Ca2+的同类络合物相近,但一般要在 或
或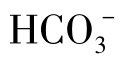 含量大于1000mg/L时才能生成上述络合物。
含量大于1000mg/L时才能生成上述络合物。
3.钠(Na+)
天然水中的钠(Na+)的溶解度都很高,在自然环境中不存在使Na+沉淀的重要反应。
Na+在天然水中最重要的特点是,不同条件下的含量差别十分悬殊。在大多数河水中含量在几mg/L至几十mg/L,含盐量高的水中Na+是最优势的阳离子,在海水中Na+的含量按质量计占全部阳离子含量的81%。
在淡水中,由于Na来源于铝硅酸盐矿物的分解,故[Na+]>[Cl-]。
在卤水中,[Na+]<[Cl-],这是由于水中存在着CaCl2与MgCl2,而自然界中的CaCl2与MgCl2的矿物不多见。这种水中的Mg2+和Ca2+的出现是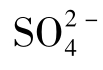 被还原消失后,高浓度Cl—Na型水中的Na+与沉积物中的Ca2+、Mg2+发生离子交换作用的结果,同时[Cl-]>[Na+]的差数可以表示与沉积物中的吸附性Ca2+、Mg2+进行交换作用的那一部分Na+的摩尔数。
被还原消失后,高浓度Cl—Na型水中的Na+与沉积物中的Ca2+、Mg2+发生离子交换作用的结果,同时[Cl-]>[Na+]的差数可以表示与沉积物中的吸附性Ca2+、Mg2+进行交换作用的那一部分Na+的摩尔数。
Na+由水中转入固相的反应是阳离子交换反应,但数量有限。也就是说,在正常的自然环境中不存在使水中Na+含量降低的反应。在Na+饱和的水中的含量可达150g/L。在干旱区的水中Na+一般在100g/L以上。
关于Na在天然水中存在的形态,在Na+含量低于1000mg/L的水中,Na+主要呈游离态,在含盐量较高的水中存在着多种离子和络合物,如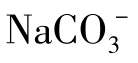 、NaHCO3与
、NaHCO3与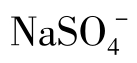 等。海水中几乎所有的阴离子都可以与Na+生成离子对。
等。海水中几乎所有的阴离子都可以与Na+生成离子对。
4.钾(K+)
钠和钾两者的化学性质相近。在天然水中K+的含量远低于Na+,K+的含量一般为Na+的4%~10%。另外,K+是植物的基本营养元素,土壤中的钾被植物吸收与固定,因此,大部分天然水中K+的含量远低于Na+。
在Na+含量低于10mg/L的淡水中,K+的含量只为Na+的10%~50%。总之,天然水中K+的浓度值范围远比Na+的浓度值小。
5.硅
在绝大多数正常天然水中SiO2的含量为1~30mg/L,地表水中SiO2的平均含量是14mg/L,地下水中的平均含量是17mg/L,少数区域可达到100mg/L,在深层地下水中有更高的浓度。表层海水中SiO2含量一般低于1mg/L,湖水中的SiO2含量也不高,这种情况显然与生物的吸收作用有关,硅通常被聚积于生物贝壳和骨骼中。
关于硅在天然水中的化学形态,在碱性水中Si(OH)4可以电离:
计算表明,当pH=8.41~8.91时,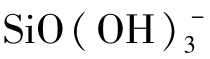 的含量占总溶解硅的10%,当pH=9.41~9.91时,
的含量占总溶解硅的10%,当pH=9.41~9.91时,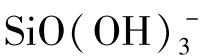 可占总溶解硅的50%。
可占总溶解硅的50%。
Si(OH)4也可生成多核络合物:
或
在中性和弱碱性条件下只有Si(OH)4生成,碱性条件下可生产单核与多核络合物,从而使硅酸盐的溶解度增加。目前尽管对硅的络合物的了解甚少,但研究表明,存在着硅的多核络合物。
在含F-的酸性水中,硅倾向于生成硅氟络离子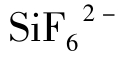 ,但在pH>4的水中含量甚微。
,但在pH>4的水中含量甚微。
6.碳酸氢根(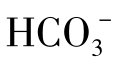 )与碳酸根(
)与碳酸根(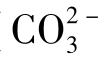 )
)
(1)碳酸化合物存在的形态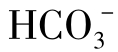 是淡水中的主要成分,天然水中碳酸化合物的来源有以下几个方面:
是淡水中的主要成分,天然水中碳酸化合物的来源有以下几个方面:
首先是空气中二氧化碳的溶解,岩石、土壤中碳酸盐和重碳酸盐矿物的溶解,如:
上述反应是可逆的,只有当水中溶有CO2时,反应才向右进行。
其次是水中动植物的新陈代谢作用以及水中有机物的生物氧化等产生的二氧化碳;有时在水处理过程中也会加入或形成各种碳酸化合物。上述各种来源的碳酸化合物综合构成水中碳酸化合物的总量。
水中碳酸化合物通常以下列几种形态存在:
①分子状态的碳酸,即溶于水中的游离碳酸,包括溶解的气体CO2和未离解的H2CO3分子。
②半化合性碳酸,即重碳酸盐碳酸,重碳酸根离子(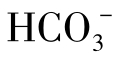 )。
)。
③化合性碳酸,即碳酸盐碳酸,碳酸根离子(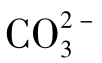 )。
)。
上述三种碳酸化合物存在着以下平衡关系:
若把各级平衡式综合起来,可以得到:
在上述两种分子状态的碳酸(游离碳酸)平衡关系中,实际上是CO2的形态占最主要的位置,而H2CO3的形态只占分子状态碳酸总量的1%以下。例如,在25℃时,[H2CO3]/[CO2]=0.0037,很难用化学方法分开测定。因此,把水中溶解的气体CO2的含量作为分子状态碳酸(游离碳酸)的总量,不会引起很大误差,在分析中可以用[CO2]或[H2CO3]代替分子状态碳酸(游离碳酸)总量,即:
或
(2)碳酸平衡和pH的关系H2CO3按下式离解:
从式(1-83)中可以看到,当[H+]=4.5×10-7,即pH=7时,[H2CO3]=[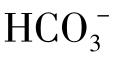 ],当pH>7时,[H2CO3]<[
],当pH>7时,[H2CO3]<[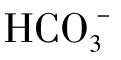 ];而当pH<7时,[H2CO3]>[
];而当pH<7时,[H2CO3]>[ ]。
]。
与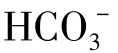 处于平衡时的CO2(l)称为平衡CO2。如果水中的CO2含量大于平衡CO2含量时,则多余的CO2将继续溶解CaCO3,这一部分CO2(l)称为侵蚀性CO2。
处于平衡时的CO2(l)称为平衡CO2。如果水中的CO2含量大于平衡CO2含量时,则多余的CO2将继续溶解CaCO3,这一部分CO2(l)称为侵蚀性CO2。
相反,当水中的CO2含量低于平衡CO2时,则式(1-82)反应向左移动。这一平衡在日常生活中可以看到,加热含大量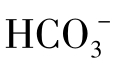 与Ca2+的水时,CO2自水中逸出,生成的CaCO3水垢沉淀物。
与Ca2+的水时,CO2自水中逸出,生成的CaCO3水垢沉淀物。
从式(1-82)、式(1-83)中还可以看出,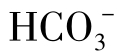 含量与[H+]成反比。计算表明,当pH<4时,水中
含量与[H+]成反比。计算表明,当pH<4时,水中 含量就非常少了,可以说在酸性水中实际上不存在
含量就非常少了,可以说在酸性水中实际上不存在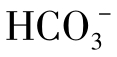 。
。
在一般河水与湖水中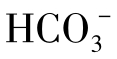 含量不超过250mg/L。地下水中的浓度是50~400mg/L,在少数情况下可达800mg/L。
含量不超过250mg/L。地下水中的浓度是50~400mg/L,在少数情况下可达800mg/L。 进一步解离生成
进一步解离生成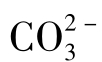 :
:
但当水中有Ca2+时,将妨碍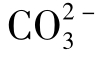 的存在,因为它易生成难溶的CaCO3沉淀。所以大部分水中
的存在,因为它易生成难溶的CaCO3沉淀。所以大部分水中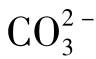 含量很低,只有当Ca2+含量极少时,才可以聚集较大量的
含量很低,只有当Ca2+含量极少时,才可以聚集较大量的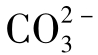 。
。
水中[CO23-]与[H+]成反比,据计算,当pH<8.3时,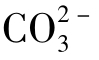 水中[CO23-]与[H+]成反比,据计算,当pH<8.3时,
水中[CO23-]与[H+]成反比,据计算,当pH<8.3时,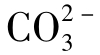 含量可以忽略不计。这也就是说,在中性和酸性水中实际不存在
含量可以忽略不计。这也就是说,在中性和酸性水中实际不存在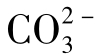 。
。
由上述可知,H2CO3、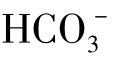 、
、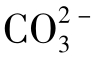 、H+和Ca2+在水溶液中有密切的数量联系,其中一种成分的改变就会引起所有其他成分的改变,这一数量关系决定于K1、K2和CaCO3的溶度积常数。所有这些对天然水构成了非常有意义的碳酸化学平衡体系。
、H+和Ca2+在水溶液中有密切的数量联系,其中一种成分的改变就会引起所有其他成分的改变,这一数量关系决定于K1、K2和CaCO3的溶度积常数。所有这些对天然水构成了非常有意义的碳酸化学平衡体系。
若把各级平衡式综合起来可以得到:
不同温度下碳酸的平衡常数值见表1-10。
表1-10 各温度下碳酸的平衡常数
设水中各种形态的碳酸的总量以c表示,则:
若c值固定,在达到平衡体系时,三种类型碳酸之间应有固定的比例。这种比例决定于溶液中氢离子的浓度。pH降低时平衡左移,游离碳酸增多,pH升高时平衡右移,重碳酸根和碳酸根增多。
如果把这三种类型的碳酸在总量中所占的比例分别以a0、a1和a2表示,则
综合式(1-83)~式(1-86)可得:
根据式(1-88)~式(1-90)可计算出不同pH时三类碳酸含量的相对比例值(a0、a1、a2),见表1-11。
表1-11 三类碳酸含量的比值(25℃)单位:%
将表1-11中各数值绘成曲线,如图1-22所示。
图1-22 三类碳酸含量的比例变化曲线
由表1-11和图1-22可以看出:
①当pH<4.3时,水中几乎只有CO2一种形态。
②当pH<8.3时,水中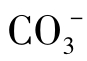 几乎没有了,主要存在CO2和
几乎没有了,主要存在CO2和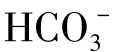 两种形态。
两种形态。
③当pH>8.3时,CO2几乎没有了,而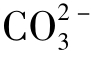 和
和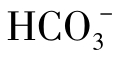 同时存在。
同时存在。
④当pH>10.3时, 迅速减少。
迅速减少。
⑤当pH>12时,水中几乎只存在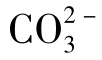 一种形态。
一种形态。
因此,可以认为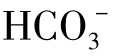 实际存在范围是pH在4.5~12,而且当pH在中等范围(6~10.5)时,
实际存在范围是pH在4.5~12,而且当pH在中等范围(6~10.5)时,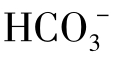 在三种类型碳酸的总量中占30%以上。三种碳酸在平衡时的浓度比例与水的pH有完全相对应的关系。
在三种类型碳酸的总量中占30%以上。三种碳酸在平衡时的浓度比例与水的pH有完全相对应的关系。
当某种碳酸的浓度受外界影响而变化时,就会引起其他各种碳酸浓度的变化以及水的pH的相应变化。同样,水的pH发生变化时,也会引起三种碳酸浓度之间的比例发生变化。由此可见,水中的碳酸平衡同pH是密切相关的。
(3)碳酸化合物平衡间的关系把碳酸的离解与CaCO3的溶解合并考虑可以得出下式:
按式(1-91)可绘出图1-23表示的水中Ca2+、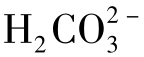 和CO2平衡含量间的关系。
和CO2平衡含量间的关系。
图1-23 CO2与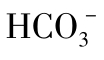 和Ca2+的平衡关系
和Ca2+的平衡关系
从图1-23中可以看出,在河水中,当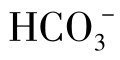 含量低于50mg/L时,水未被CaCO3饱和。因为此时水中的CO2含量小于平衡CO2含量(0.59mg/L)。此时水中的
含量低于50mg/L时,水未被CaCO3饱和。因为此时水中的CO2含量小于平衡CO2含量(0.59mg/L)。此时水中的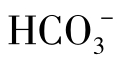 是不稳定。当河水中
是不稳定。当河水中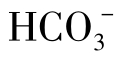 含量为0.8~1.1mmol/L(50~70mg/L)时是最稳定的。在地下水中,由于CO2含量高,水中的
含量为0.8~1.1mmol/L(50~70mg/L)时是最稳定的。在地下水中,由于CO2含量高,水中的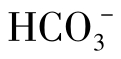 达到3~4mmol/L(180~240mg/L)时仍是最稳定的。
达到3~4mmol/L(180~240mg/L)时仍是最稳定的。
7.氯(Cl-)
Cl-在天然水中有广泛的分布,几乎所有的水中都存在Cl-,但含量差别很大,某些河水中的Cl-含量为几个mg/L,海水中为19g/L,而在某些卤水中含量达190g/L。淡水中Cl-的含量低于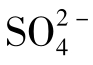 和
和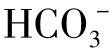 ,海水中三者的含量顺序正相反。
,海水中三者的含量顺序正相反。
天然水中Cl-的较重要的来源与蒸发岩有关,氯在岩石中的含量远比天然水中其他主要成分低。火成岩中的含氯矿物主要是方钠石Na8[Cl2(AlSiO4)6]和氯磷灰石Ca5(PO4)3Cl。在细颗粒的海洋泥质中长期地保留着氯化物。所有这些岩石和沉积物中,Na+与Cl-伴生在一起。计算表明,16km厚的地壳中的氯有3/4存在于海水溶液中。
与天然水中其他离子相比,Cl-的化学行为最为简单。氯化物不参与任何氧化还原反应,不与其他主要阳离子生成络合物,Cl-在总的生物化学循环中所起作用有限。因此,在水文循环中氯的转移基本上是一种物理过程。由于Cl-的化学行为简单,在地下水动力学的研究中常被作为示踪剂使用。
在阴离子以Cl-占优势的水中同时阳离子以Na+占优势,Cl-与Na+在天然水中有等摩尔积累的趋势,其含量与天然水中溶解性固体总量的增长呈正比,完全不同于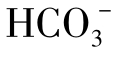 、Ca2+、Mg2+、
、Ca2+、Mg2+、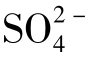 在天然水中的积累过程,这一情况与各种钠盐及各种氯化物在水中有很高的溶解度有关,如图1-24所示。
在天然水中的积累过程,这一情况与各种钠盐及各种氯化物在水中有很高的溶解度有关,如图1-24所示。
图1-24 地下水中各类离子与水中溶解物总量的关系
(其中Ca2+、Mg2+、 均乘1/2)
均乘1/2)
8.硫酸根(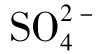 )
)
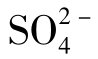 是天然水中含量居中的阴离子。在淡水中,[
是天然水中含量居中的阴离子。在淡水中,[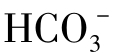 ]>[
]>[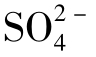 ]>[Cl-],咸水中正好相反,[Cl-]>
]>[Cl-],咸水中正好相反,[Cl-]>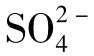 ]>[
]>[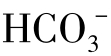 ]。
]。
硫以还原态金属硫化物的形式广泛地分布在火成岩中。当硫化物与含氧水接触时便被氧化,生成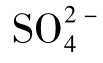 离子。火山喷气中的SO2及一些泉水中的H2S也可被氧化为
离子。火山喷气中的SO2及一些泉水中的H2S也可被氧化为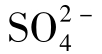 ;沉积中的石膏与无水石膏是天然水中
;沉积中的石膏与无水石膏是天然水中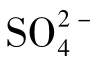 的重要来源;含硫的动、植物残体分解也影响着天然水中
的重要来源;含硫的动、植物残体分解也影响着天然水中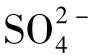 的含量;NaCl溶液的存在,可使CaSO4的溶解度增大。
的含量;NaCl溶液的存在,可使CaSO4的溶解度增大。
简单系统中Ca2+与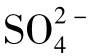 的浓度是等摩尔的,25℃条件下当水中不含NaCl时,
的浓度是等摩尔的,25℃条件下当水中不含NaCl时,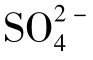 的含量为1.480mg/L,在Na++Cl-的含量为2500mg/L时,
的含量为1.480mg/L,在Na++Cl-的含量为2500mg/L时,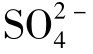 的含量增加到1.800mg/L。
的含量增加到1.800mg/L。
SrSO4与BaSO4的溶度积为10-6.5和10-10.0,即在含有10mg/LSr2+的水中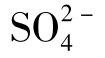 含量不会超过几百mg/L。
含量不会超过几百mg/L。
MgSO4与NaSO4的溶解度较高。当水中含有Na2SO4、MgSO4并同时含少量Ca2+时, 含量可达到100000mg/L,但这种情况只能在天然卤水中看到。
含量可达到100000mg/L,但这种情况只能在天然卤水中看到。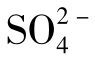 水化学性质的一个特点是易与某些金属阳离子生成络合物和离子对,其中最常见的有
水化学性质的一个特点是易与某些金属阳离子生成络合物和离子对,其中最常见的有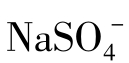 和CaSO4等。
和CaSO4等。
在低pH的天然水中硫酸的离解是不完全的,可生成相当数量的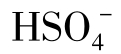 。
。
当pH=1.9时,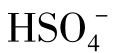 是优势离子。
是优势离子。
当pH=2.9时,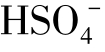 只占硫酸根总量的10%左右。
只占硫酸根总量的10%左右。
当pH>3.9时,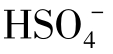 的含量就微不足道了。
的含量就微不足道了。
天然水中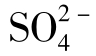 含量除决定于硫酸盐的溶解度外,还决定于环境的氧化还原条件。在还原条件下
含量除决定于硫酸盐的溶解度外,还决定于环境的氧化还原条件。在还原条件下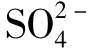 是不稳定的,可被细菌还原为自然硫和H2S,因此,这类水中无
是不稳定的,可被细菌还原为自然硫和H2S,因此,这类水中无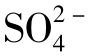 存在。
存在。
9.铁离子(Fe2+,Fe3+)
铁在岩石、土壤和水体中以各种各样的形式和氧化态存在。铁最常见的矿物源(沉积物)包括氧化铁和氢氧化铁,例如,使岩石呈红色的赤铁矿(Fe2O3)和使土壤呈黄色的氢氧化铁[Fe(OH)3]。在富氧的地表水中(pH=5~8),总铁的浓度为0.05~0.2mg/L;在地下水中,铁的浓度普遍在1~10mg/L;在低碳酸盐和低氧浓度的水体中,铁的浓度可能会更高(高达50mg/L)。
10.锰离子(Mn2+)
锰在岩石土壤中的含量非常丰富,通常是以与其他金属阳离子配合的氧化锰和氢氧化锰的形式存在。在较低或中等pH下,锰最主要的溶解态是二价锰(Mn2+)。浓度通常为0.1~1mg/L,在低pH下,可能有更高的浓度。在地下水中,锰通常是和铁并存的,像铁一样,可能引起洗涤和固定染色等感官指标上的问题。
11.氟离子(F-)
虽然地壳岩石中氟元素的含量远大于氯元素,氟元素却更大程度地结合在矿物质中。萤石(CaF2)是氟元素通常的矿物形式,氟磷灰石[Ca5F(PO4)3]中也含有氟元素。在天然水体中,氟元素的存在形式主要是氟离子或者铝、铍及铁离子形成的配合物。在TDS小于1000mg/L的水体中,氟的浓度通常小于1mg/L,而受火山活动影响的地下水中,氟的含量可能高于10mg/L。
12.氮(N)
水中的氮元素及氮相应的氧化物在水体/土壤环境下最主要的存在形式是氨气(NH3,-Ⅲ),铵根离子(NH4+,-Ⅲ),氮气(N2,0),亚硝酸根离子(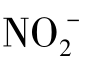 ,+Ⅲ),硝酸根离子(
,+Ⅲ),硝酸根离子(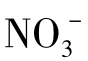 ,+Ⅴ)。氮元素在大多数有机物中氧化态是-3价。氮元素的氧化态从-3到+5价,总结如下:
,+Ⅴ)。氮元素在大多数有机物中氧化态是-3价。氮元素的氧化态从-3到+5价,总结如下:
氮元素在水中的其他形式包括尿素(NH2CONH2)、氨基酸及其分解物在内的有机物,还有氨气(NH3)、铵根离子(NH4)、羟胺(NH2OH)、氮气(N2)和亚硝酸根(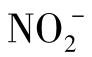 )。氨气、铵根离子和蛋白质的分解物都是还原态物质,氮气是零价态的,亚硝酸根是+3价,而硝酸根是+5价。氮元素从一种价态转化到另一种价态是与生物活动、城市污水的流入以及氮肥的利用紧密相关的。
)。氨气、铵根离子和蛋白质的分解物都是还原态物质,氮气是零价态的,亚硝酸根是+3价,而硝酸根是+5价。氮元素从一种价态转化到另一种价态是与生物活动、城市污水的流入以及氮肥的利用紧密相关的。
13.二氧化硅(SiO2)
二氧化硅几乎存在于所有的岩石、土壤和天然水体中。在水中,二氧化硅会水化为H4SiO4或Si(OH)4,虽然在水分析中,通常把溶解的二氧化硅表示为SiO2。在大多数天然水中二氧化硅的浓度为1~30mg/L。二氧化硅的溶解性很复杂,其中温度是关键的影响因素。在水处理中,硅酸钠被用作混凝剂,而在铁管中被用作缓蚀剂。
14.硫(S)
硫元素在天然水体中的存在形式是硫酸根(如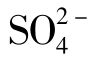 )和硫化物(如H2S、HS-、Na2S2O3)。硫酸根的主要来源是蒸发岩,蒸发岩是由于水蒸发和矿物沉积而形成的,例如,石膏(CaSO4·2H2O)和硬石膏(CaSO4)。沉积岩比如黄铁矿(FS2)、降雨和细菌代谢物。在富氧水中硫酸根的浓度通常为5~30mg/L。
)和硫化物(如H2S、HS-、Na2S2O3)。硫酸根的主要来源是蒸发岩,蒸发岩是由于水蒸发和矿物沉积而形成的,例如,石膏(CaSO4·2H2O)和硬石膏(CaSO4)。沉积岩比如黄铁矿(FS2)、降雨和细菌代谢物。在富氧水中硫酸根的浓度通常为5~30mg/L。
15.铝离子(Al3+)
通常不存在于水中,除非铝金属遭受腐蚀,或预处理铝盐凝聚剂后,Al3+浓度(以Al2O3计)为1~3mg/L,将会加速沉积物生成。
16.锌离子(Zn2+)
以抑制剂形态出现,在电化学腐蚀反应中可充当牺牲阳极,但对鱼类有害,排放要求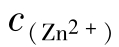 ≤5mg/L,渔场要求
≤5mg/L,渔场要求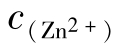 ≤0.1mg/L。在pH≥8.3时,发生锌沉积。
≤0.1mg/L。在pH≥8.3时,发生锌沉积。
有关工业循环冷却水处理的文章

表1-12 淡水中主要无机络合物表1-13列举了25℃、1.01×105Pa条件下,天然水中主要无机离子缔合体的稳定常数。表1-13 天然水体中主要无机离子缔合体的稳定常数表1-14列举了海水中主要离子缔合体组成。这是因为它们属硬酸离子,且海水中的浓度远高于与其络合的阴离子的浓度。而、及的情况则不同,只有相应数量的阴离子与阳离子结合。压力对离子缔合体生成的影响可以根据摩尔体积估算。......
2023-06-30

天然水中存在的杂质主要由所接触的大气、土壤等自然环境所引入,同时人类活动产生的各种污染物也会进入天然水体。按不同的原则,可以对天然水体中的杂质进行分类。表1-1水中杂质的尺寸与外观特征悬浮物主要是泥砂类无机物质和动植物生存过程中产生的物质或死亡后的腐败产物等有机物。天然水中所含有的无机杂质主要是溶解性的离子、气体及悬浮性的泥沙。天然水中的有机物与水体环境密切相关。......
2023-06-19

按优势阴离子将天然水划为重碳酸盐类、硫酸盐类和氯化物盐类。每一类中再按优势阳离子划分为钙质、镁质和钠质三个组。此型水含有大量Na+和K+,水中主要含与Na+,此型水多半是低离子含量水。此型水也是混合水,由于离子交换使水的成分变化剧烈。通常是天然水中的Na+被土壤和含水层中的Ca或Mg所交换。图1-26 天然水按优势阴离子分类第Ⅳ型水的特点是:[]=0,即酸性水。此外,根据所研究的内容不同,还可将天然水按硬度、碱度分类。......
2023-06-30

使用天然清洁剂时,首先要核实其是否适宜自身皮肤类型。若无异常时可使用;若出现变红或瘙痒感时停止使用。麦饭石吸收皮肤产生的热能量,并使吸收的热量增加,从而促进新陈代谢和提高皮肤免疫力。鸡蛋黄的卵磷脂成分能使皮肤变得营养且有光泽;大豆的皂角成分能去除角质,改善细纹。然后在黄瓜汁里放入适量的绿豆粉搅拌,按适当比例调和好。材料:鸡蛋清1个,当归粉1小勺,甘草粉1/2小勺,面粉1小勺。......
2023-08-17

塑料是以合成树脂为主要成分,并根据不同需要添加不同添加剂所组成的。塑料按其成分不同,可分为简单组分和多组分的塑料。填充剂的用量通常为塑料组成的40%以下。塑料的老化现象,就是由增塑剂中的某些挥发物质逐渐从塑料制品中逸出而产生的,因此,在塑料中应尽量减少增塑剂含量。因此,在大多数塑料中都要添加稳定剂,用以减缓和阻止塑料在加工和使用过程中的分解变质。......
2023-06-26

利用熔透法焊接时,应适当降低等离子气流量,以减小等离子流力。因此,焊接速度、离子气流量及焊接电流这三个工艺参数应相互匹配。大电流焊接时保护气和等离子气应用同种气体以提高电弧的稳定性。对不留间隙的Ⅰ型对接接头进行等离子弧焊时一般可不填充焊丝。......
2023-06-23

经过试验,HCPE含量在15%~25%之间能够得到较好的防腐蚀涂层。因此,单一选用HCPE制备防腐蚀涂料远远不能达到要求,需要用其他合成树脂或天然树脂进行改性,才能获得较为理想的综合性能。......
2023-06-23

表面活性物质亦称表面活性剂或界面活性剂,是一种能显著降低液体表面张力的物质,是清洗剂中不可缺少的成分。汽车清洗剂中的表面活性物质主要有软肥皂和合成清洗剂。它在清洗剂中的主要作用是能够使溶液的pH值几乎维持不变。在清洗过程中,酸性污垢必定耗用碱盐,水玻璃维持溶液碱性的缓冲效果约为其他碱盐的2倍,因此能降低清洗剂的消耗。在清洗剂配方中以缩合磷酸盐最重要。......
2023-09-29
相关推荐