当然,OB35的周期设置可以根据工艺实际要求而定。表9-3 PID软件编程步骤为了保证执行频率一致,块应当在循环中断OB中调用。图9-3 设置SFB41的背景DB为DB3具体的PID调用程序如图9-4所示。图9-4 PID程序调用在PID程序调用中,“CYCLE”参数对应的是扫描时间,必须将程序块调用的间隔时间赋值在这里。当前值显示在窗口的右上部。9)单击“关闭”按钮,终止曲线记录器的功能。......
2025-09-29
1.镁液中的化学反应
(1)镁与氧的反应
金属镁是极活泼的元素,在固态时就可以氧化。在大气下熔炼时,镁熔体与空气中的氧直接接触,将产生强烈的氧化作用,生成氧化镁,其反应式为

熔炼镁合金时,一般当温度超过350℃时就应通入保护气体,以减少固态的氧化。镁一经氧化,就变成氧化物,通常称为氧化烧损。镁与氧的化学亲和力很大,而且生成的氧化膜是疏松的(致密度系数α=0.79)。虽然在较低温度下镁的氧化速度不大,但当温度超过熔点,镁处于液态时,其氧化速度大大加快,镁液遇氧时即发生氧化而燃烧,放出大量的热,而生成的MgO层绝热性又很好,使反应生成的热量不能很好地散出去,因而提高了反应界面的温度,温度的提高又反过来加速了镁的氧化,使燃烧加剧。如此循环下去,将使反应界面的温度越来越高,最高可达2850℃,此时已引起镁的大量汽化,使燃烧大大加剧,引起爆炸。
若在镁液中添加少量的Be(wBe=0.002%~0.01%)可以提高镁熔体的抗氧化能力。这是因为Be是镁的表面活性元素,富集于镁熔体表面,致使熔体表面含Be量为合金的10倍,并优先氧化。BeO的致密度系数α=1.7l,故BeO充填于氧化膜孔隙中形成致密的复合氧化膜。但Be的加入量不宜过多,过多会引起晶粒粗化,恶化力学性能,并加剧热裂倾向,当温度大于750℃时,Be对提高镁的抗氧化的作用大为降低。
(2)镁与水蒸气的反应
镁无论是固态还是液态均能与水发生反应,其反应方程式如下:
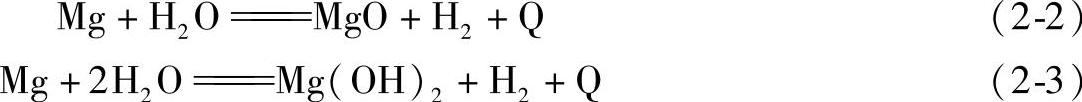
式中Q为热量。
在室温下,反应速度缓慢,随着温度升高,反应速度加快,并且Mg(OH)2会分解为H2O及MgO,在高温时只生成MgO。在其他条件相同时,镁与水蒸气间的反应将较Mg—O间的反应更为激烈。当熔融的镁液与水接触时,不仅由于发生上述反应而放出大量的热,而且还因为反应产生的氢与周围大气中的氧迅速反应以及液态的水受热而迅速汽化,导致猛烈的爆炸,引起镁液的剧烈飞溅。因此合金炼镁合金时,与合金液相接触的炉料、工具、熔剂等均应干燥。镁与水的反应也是镁熔体中氢的主要来源,这将导致镁合金铸件出现缩松等缺陷。
(3)镁与氮气的反应
镁与氮气的反应方程式如下:

式(2-4)的反应在室温下速度极慢,当镁处于液态时,反应速率加快,生成多孔性Mg3N2膜,该膜不能阻止反应的继续进行,不能防止镁的进一步蒸发,因此氮气不能阻止镁熔体的氧化和燃烧。Mg与N2反应的激烈程度比Mg-O、Mg-H2O间的反应要弱得多。
氮还能与镁合金中的元素反应,生成氮化物,形成非金属夹渣,影响金属的纯度,直接影响合金的耐蚀性和组织上的稳定性。这是由于氮化物不稳定,遇水时,氮化镁会发生分解,反应方程式如下:

(4)镁与CO2、CO的反应
镁与CO2、CO反应生成(Mg2C+MgO)复合物。在低温下,反应进行十分缓慢。因此可以认为,这两种气体对固态镁是惰性气体。在高温下,镁与CO2、CO气体间的反应将会加速,不过其程度远较Mg-H2O及Mg-O反应小。反应生成的表面膜有一定的防护作用。实验研究表明,在700℃下采用密封坩埚熔炼镁合金,CO2的防护性尚好。
一般认为CO2与镁在高温下产生如下反应:
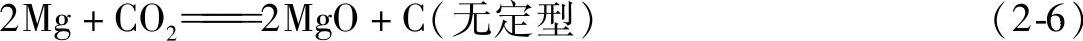
实验证明:处于各种温度下的镁在干燥、纯净的CO2中,其氧化速度均很低,这与表面膜中出现了无定型碳密切相关。这种无定型碳存在于氧化膜的空隙处,提高了镁表面膜的致密度系数,为α=1.03~1.15。带正电荷的无定型碳,还能强烈地抑制镁离子透过表面膜的扩散运动,故也能抑制镁的氧化。在纯净、干燥的CO2气氛中,700℃左右镁熔体表面形成晶莹的有金属色泽的薄膜,此膜具有一定的塑性,但随着温度的升高,表面膜渐渐变厚变硬,致密度逐渐降低,随后发生开裂,表面膜也就失去了防护作用,镁开始燃烧。
(5)镁与硫及SO2的反应
1)镁与硫的作用。
硫与镁接触时,一方面受热蒸发(硫的沸点为444.6℃),形成SO2保护性气体,另一方面硫与镁熔体反应,在熔体表面形成较致密的MgS膜(致密度系数α=0.95),减缓了镁熔体的氧化。
2)镁与SO2的作用。
反应方程式如下:
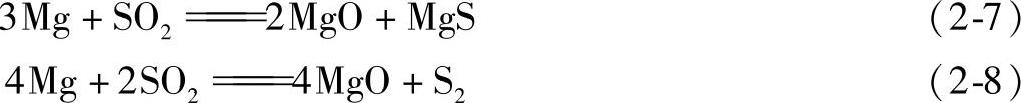
生成的2MgO+MgS复合表面膜近似严密,所以具有阻缓镁液氧化的作用,因此,SO2对镁熔体有一定的防护作用。当SO2从气氛中消失,该表面膜就会破裂,镁熔体即发生燃烧。当温度高于750℃时,此膜也将破裂,不再起防护作用,SO2将与镁液发生剧烈反应而生成大量硫化物夹杂。
2.镁液的吸气
与铝合金熔炼的吸气过程极其相似,镁液中的气体主要也是氢气。镁合金中的氢主要来源于熔剂中的水分、金属表面吸附的潮气以及金属腐蚀带入的水分。镁合金的吸气机理如下:(https://www.chuimin.cn)
Mg+H2O=MgO+H2 (2-9)

P.Bakke等从动力学方面进行了阐述,如图2-10所示,认为氢从大气进入镁熔体中大致经历了下面五个阶段:
1)在镁熔体表面上方水蒸气扩散到气液边界。
2)水分子在气液表面吸附。
3)镁与吸附的水蒸气发生发应生成氢气,见式(2-9)。
4)生成的氢气在界面上离解成原子态的氢,见式(2-10)。
5)氢原子通过扩散和传质进入镁熔体中。
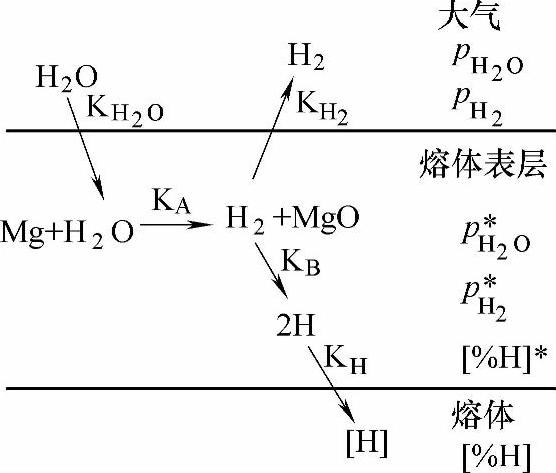
图2-10 氢从大气进入镁液中的溶解机理
镁合金中的最大缺陷是显微气孔。试验表明,在生产条件下,当100g镁中氢含量超过10~14.5cm3时,镁合金中就会出现显微气孔。2025年,Mikucki等报道:显微气孔与氢含量成正比,甚至氢含量在固相溶解度下时也是这样。他们采用改进的氢分离法测试氢含量,并推导出镁合金中的氢气与气孔的关系。气孔的存在严重地危害镁合金件的力学性能和气密性等性能,有时直接导致铸件的报废。
3.夹杂物的形成及危害
(1)夹杂物的危害
由于镁合金化学性质极其活泼,在原镁生产过程中以及合金熔炼、合金化处理、金属传输及铸造等过程中极易产生氧化及熔剂夹杂。夹杂物一般以薄膜状、粒子状或团簇状的形态残留在镁合金铸件的基体或晶界上,降低零件的力学性能、疲劳性能,或者让零件直接报废。
(2)夹杂物的来源
1)原镁冶炼。
原镁的生产方式有电解法和硅热法(皮江法)两种。在电解法生产镁的过程中,电解质如MgCl2、NaCl等氯盐容易混入镁液中。此外,电解槽中的含碳材料与镁液中的微量元素如Al、Ca等反应形成碳化物。
2)镁氧化。
由于镁极易被氧化,镁与空气中的氧反应生成MgO,这是镁合金夹杂物的主要部分;镁会与空气中的氮反应生成Mg3N2。当镁合金熔炼在SF6气体保护下进行时,SF6与镁液反应形成MgF2、MgS等夹杂物。
3)镁合金除Fe及变质。
镁合金中的Fe是影响镁合金耐蚀性能的有害杂质,应除去。除Fe一般需要加Mn,Fe与Mn形成FeMn中间化合物,如果没有足够的静置时间,该化合物会残留在镁液中形成夹杂物。
4)铸造工艺。
当镁液与模具中的涂料或润滑剂接触时,高温下也会产生化学反应形成夹杂物。
(3)夹杂物分类
1)非金属化合物类夹杂。
包括镁的氧化物和氮化物,如MgO,Mg3N2,Na、Ca、K基氯化物(NaCl、CaCl2、KCl等),Al、Ca的碳化物Al4C3、CaC,镁的硫化物MgS、氟化物MgF2及硫酸盐MgSO4等。
2)金属间化合物类夹杂。
主要是富铁相,如α-Fe粒子、锰-铁金属化合物[MnAl6、Fe2(Si,B)、Fe3(Al,Si)、(Fe,Mn)3Si、(Fe,Mn)5Si3]等。
镁合金的净化包括两方面的内容:一是去除镁熔体内的夹杂物;二是降低其含有的有害元素(Fe、Ni、Cu、Cl)的水平。
相关文章

当然,OB35的周期设置可以根据工艺实际要求而定。表9-3 PID软件编程步骤为了保证执行频率一致,块应当在循环中断OB中调用。图9-3 设置SFB41的背景DB为DB3具体的PID调用程序如图9-4所示。图9-4 PID程序调用在PID程序调用中,“CYCLE”参数对应的是扫描时间,必须将程序块调用的间隔时间赋值在这里。当前值显示在窗口的右上部。9)单击“关闭”按钮,终止曲线记录器的功能。......
2025-09-29

冷镦不锈钢中,非金属夹杂物的含量和状态,对钢的冷镦裂纹的产生起着重要的影响。因此,欲降低冷镦制品的裂纹率,必须降低D类夹杂在钢中含量。下面介绍降低冷镦不锈钢中非金属夹杂物的措施。总之,采用中性铝镁尖晶石坩埚和中性炉渣来冶炼冷镦不锈钢,会明显地降低钢中D类夹杂物。......
2025-09-29

以腐蚀技术为主体的硅加工它包括湿法腐蚀与干法腐蚀,腐蚀技术的工艺稳定性较差,制作的微结构件形状受限制。LCLD&RP技术的缺点是:加热时液体的流动性及有些反应会产生少量的气体或气泡等,使沉积质量受到一定的影响,但可以通过控制工艺和一些反应条件来加以改善。......
2025-09-29

在各种控制系统中可以采用不同的逻辑控制装置,实质上就是不同的控制器件。现在常见的控制装置主要有继电器装置、可编程序控制器装置和微机装置。电气控制系统无论控制装置如何改变,整个系统组成基本上都是一致的,主要有四个部分。(二)中间处理部分主要包含所有的中间控制器件,如各种中间继电器、可编程序控制器、专用微机等。这是电梯控制系统中各种操作的实际执行部分。......
2025-09-29

局部氧化法生成的氰酸盐虽然毒性低,仅为氰的千分之一。图3-2两级氧化处理含氰废水基本工艺流程碱性氧化法处理含氰电镀废水,应设置调节池。图3-3一级连续氧化处理含氰废水流程图含氰废水用泵从调节池经两个串联管状混合器送入翻腾式反应池。图3-4连续式完全氧化工艺流程图......
2025-09-29

在设计阶段的洪水调节计算中,考虑洪水预报应持特别谨慎的态度。推求图G5.16中水库的出流过程,其中bc段与无闸门控制的调洪计算方法完全相同。图G5.16控制与自由泄流相结合2.水库下游有防洪要求的调洪计算当水库下游有防洪要求时,且水库与下游防洪地区之间无区间入流或区间入流可忽略时,水库采用分级控制泄流的调洪方式。图G5.17,针对防护对象标准的洪水,洪水来临时水库处于防洪限制水位。......
2025-09-29

臭氧氧化法在废水处理中主要是使污染物氧化分解,用于降低BOD、COD,脱色、除臭、除味,杀菌、杀藻,除铁、锰、氰、酚等,现举例如下。废水经生物处理后进行臭氧氧化法脱色处理。印染废水的色度,特别是水溶性染料,用一般方法难于脱色,采用臭氧氧化法可得到较高的脱色率,设备虽复杂,但废水处理后没有一次有害物质产生。......
2025-09-29

定差减压阀保持阀的出口压力和进口压力为一恒定差值,这种阀通常与节流阀组合构成调速阀。定值减压阀常简称为减压阀,除特别声明外,指的都是定值输出减压阀。当压力油从油口p1 流向油口p2时,单向阀关闭,减压阀正常工作。如油液反向从p2进入,则减压阀不起作用,可通过单向阀进入油口p1,图中L 是泄油口。图4.44减压阀应用之一图4.45减压阀应用之二图4.45 所示的液压缸是一个夹紧缸。......
2025-09-29
相关推荐