从各类腐蚀失效事故统计来看,全面腐蚀占17.8%,局部腐蚀占82.2%。其中应力腐蚀断裂为38%,点蚀为25%,缝隙腐蚀为2.2%,晶间腐蚀为11.5%,选择腐蚀为2%,焊缝腐蚀为0.4%,磨蚀等其它腐蚀形式为3.1%。应力腐蚀开裂由机械的因家所产生的腐蚀现象,也称为应力腐蚀,也是局部腐蚀的一个大类。应力腐蚀开裂一般发生在合金中,并与特殊的腐蚀介质联系在一起。应力腐蚀开裂的特点是,大部分表面实际上没有遭到破坏,只有一部分细裂纹穿透金属或者合金内部。......
2023-06-19
1.电偶腐蚀与电偶序
两种不同金属在同一腐蚀介质中相接触,原来电极电位较低的金属因接触而引起腐蚀速度加快的现象称为接触腐蚀或异金属接触腐蚀。此时两种不同金属间构成电偶,又称电偶腐蚀。
电偶腐蚀的推动力是在同一介质中该两种金属的腐蚀电位之差,所以必须用非平衡电极电位的电偶序来预测电偶关系。电偶序是按金属在特定的电解液中实测的腐蚀电位值的大小排列而成的表。电偶序都是实验测定的结果,同一材料在不同介质中其电偶序不一样,一般两金属之间的电位差小于50mV时,就可以不考虑电偶腐蚀效应。由于实际的腐蚀环境中很难得到确定而重现性好的稳定电位,因此一般的电偶序表中不引用实测的金属电位值,通常只列出金属稳定电位的相对关系。表2-7所列的是某些金属或合金在海水中的电偶序。
在表2-7的电偶序中,位于表上方的某种金属和位于下方的另一种金属在海水中组成电偶对时,位于上方的金属是阳极,位于下方的金属是阴极。表2-2中上下位置相隔较远的两种金属在海水中组成电偶对时,阳极金属受腐蚀较严重,因为从热力学上说,两者的开路电位差越大,腐蚀的推动力也越大。位于表中同一行的金属,又称为同组金属,表示它们之间的电极电位相差很小(一般小于50mV),当它们在海水中组成电偶对时,腐蚀倾向小至可以忽略的程度。如铸铁-软钢、黄铜-青铜等,它们在海水中接触使用时,不必担心会引起严重的电偶腐蚀。
2.差异效应
外加阳极极化对金属自腐蚀速度的影响称为差异效应。外加阳极极化可以通过外接电源来实现;也可用与另一腐蚀电位较正的金属短接来实现。自腐蚀速度是指金属上腐蚀微电池中微阳极的阳极溶解速度。外加阳极极化使金属自腐蚀速度减小则称为正差异效应;外加阳极极化使金属自腐蚀速度加快则称为负差异效应。
(1)正差异效应 通常的腐蚀情况都存在正差异效应。极化是电极反应的阻力,其数值等于克服此阻力所需的附加推动力,因此极化总是使腐蚀速度减慢。
图2-3所示是某金属的极化曲线图,原来的腐蚀电位为φc、腐蚀电流为ic。当阳极极化到φ1时,金属上总的腐蚀速度为ia,但其中自腐蚀电流为ik,可以看出ic<ik。图中ia-ik是外电流,其阴极过程是在辅助电极上发生的。由图2-3可知,阳极极化后,金属的总腐蚀量增大了,但总腐蚀量是微观电池腐蚀和电解腐蚀之和,其中微观电池的自腐蚀速度在阳极极化后是减小的,所以是正差异效应。
表2-7 某些金属或合金在海水中的电偶序(常温)

(2)负差异效应 在某些腐蚀情况下,阳极极化并不引起自腐蚀速度的降低,而相反地引起自腐蚀速度的加快,这就是负差异效应。如Al与Pt在0.5mol/L的HCl溶液中接触后,或Mg与碳钢在0.5mol/L的NaCl溶液中接触后都呈现出负差异效应。

图2-3 某金属的极化曲线图
这种反常现象的原因:
1)阳极极化能使金属的保护膜破坏或减薄(过钝化),因而增加了自溶解速度。如Al在HCl溶液中,因与Pt接触后产生的阳极极化加速了膜的破坏,因而呈现负差异效应。有一个实验现象支持这一观点,即在碱性溶液中或汞齐化状态下研究Al的阳极极化行为,因为此时Al表面不存在保护膜,因而不再呈现负差异效应而呈现正差异效应。
2)阳极上的电极过程和预期的阳极反应不相符合。如Mg与阴极性组分Fe接触后,Mg在阳极过程中不能直接生成Mg2+离子,而是生成价数较低(与该金属离子的稳定状态相比)的阳离子(如Mg+离子)或超微的在溶液中均匀分散的金属粒子(Mg粒子)。这样生成的Mg+离子或超微分散的Mg粒子,在溶液中再与H+或H2O发生次生反应而转化为稳定的二价形式:
Mg++H+→Mg2++1/2H2
次生反应中生成的等当量的H2,也在阳极空间放出,因此在测定时发现为负差异性。
3.电偶腐蚀的速度
两块金属M1、M2其面积分别为Ac1、Ac2,腐蚀电位分别为φc1和φc2且φc1<φc2。当M1与M2直接接触组成电偶后,设溶液电阻电压降忽略不计,则两块金属都移向一个相同的电位φg,φg称为接触电位,并且φc1<<φc2。此时M1受阳极极化,M2受阴极极化(图2-4)。
根据腐蚀电流公式可以知道,在φg点的i1、i2值为
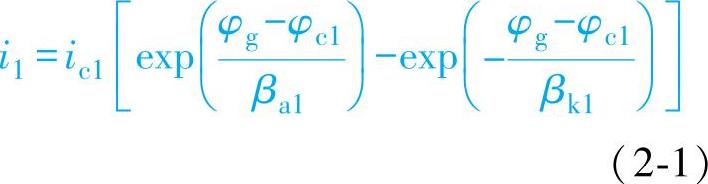

图2-4 接触腐蚀的极化曲线示意图
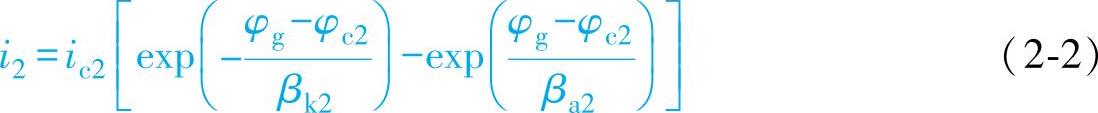
由于发生电偶腐蚀时,阳极区的面积和阴极区的面积往往相差很大,因此i1和i2的交点没有太大的意义,而ic1Ac1和ic2Ac2的交点表示的是电偶腐蚀的电流Ig

根据式(2-1)、式(2-2)和式(2-3)就能求得φg和Ig,下面以几个较简单的典型例子进行说明。
1)若φg离φc1、φc2都比较远时,式(2-1)、式(2-2)中的exp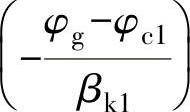 和
和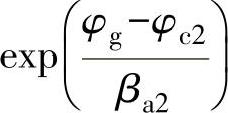 这两项可以忽略,求解后可得接触电位φg和接触腐蚀电流Ig。
这两项可以忽略,求解后可得接触电位φg和接触腐蚀电流Ig。
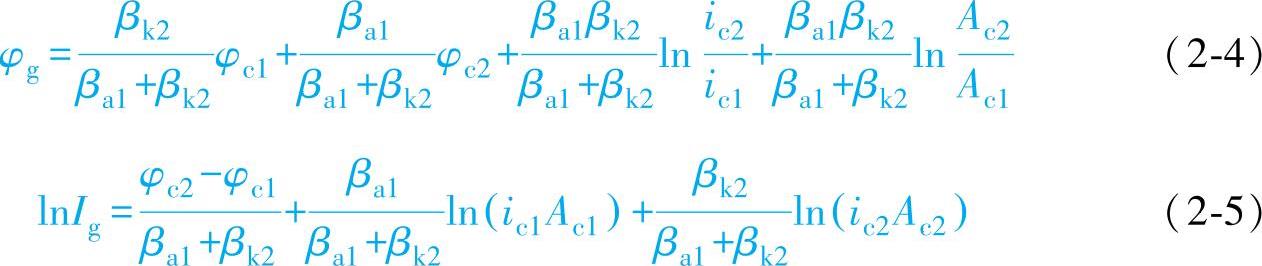
φg和Ig均可由实验测得,测定Ig时需用零电阻电流计。
在研究接触腐蚀时,还必须知道腐蚀电池的阳极M1的溶解电流密度(图2-4)

接触腐蚀速度ig表示被电偶激化后的腐蚀速度
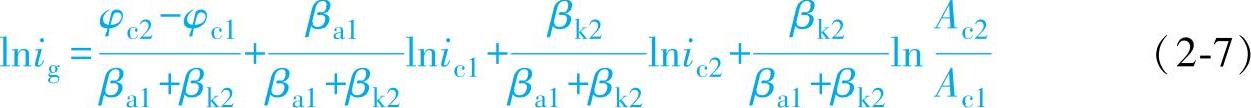
但直接反映接触腐蚀程度的还不是(i1)φg本身,而是它与接触前腐蚀速度的比值γ,此比值表示了金属在接触前后腐蚀速度改变的情况,称为接触腐蚀效应。
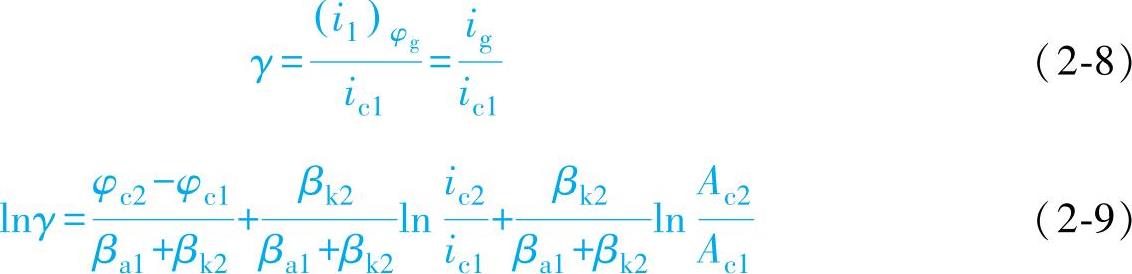
由式(2-9)可知,接触腐蚀效应γ与两种金属的腐蚀电位之差、两种金属的面积比、两种金属未接触前的腐蚀速度及两种金属相应的Tafel斜率有关。由式(2-7)、式(2-9)还可发现,lnig或lnγ同ln(A2/A1)之间呈线性关系

故只要用两个已知的面积比求得ig或γ,然后作出lnig(或lnγ)~ln(Ac2/Ac1)直线图,根据此图就可以推出其他面积比的ig和γ值。如果直接斜率已知的话,只要一次测量就可得出这条直线。
电偶腐蚀能加速腐蚀,但不是接触后才引起腐蚀,电偶腐蚀本身就能进行。
2)φg与φc1较接近,接触后M1上还同时存在有自腐蚀的阴极过程时,两金属M1、M2接触后,电位都移到φg,但在M1表面上去极化剂的阴极还原反应仍
不能忽略(图2-5)。

图2-5 接触腐蚀时的极化曲线示意图(二)
此时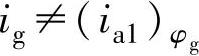 ,
,
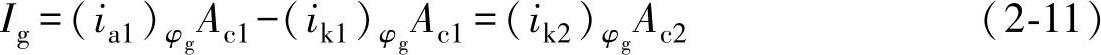
假定在M1、M2上还原反应的平衡电位都是φek,Tafel斜率都是βk,根据
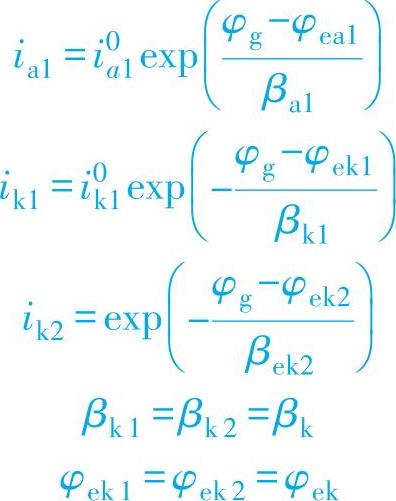
得

可以证明,当Ac1i0k1≪Ac2i0k2时,式(2-12)、式(2-14)可以还原为式(2-4)、式(2-7)。
在M1上的阴极过程不能忽略时,ig不再是金属M1的腐蚀速度了,M1在电偶极化后的腐蚀速度应该是ig加上M1上的自腐蚀速度,即
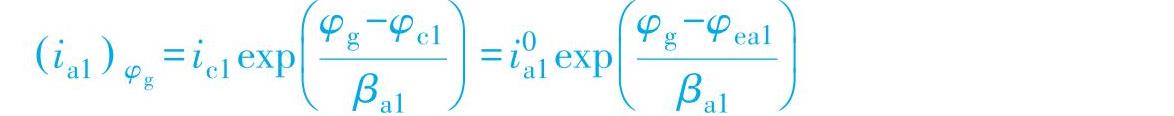
这时表征接触腐蚀效应的γ应该是M1在电位为φg时的阳极溶解电流密度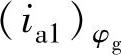 与ic1的比值
与ic1的比值

由于

因此

故接触腐蚀效应主要取决于两个比值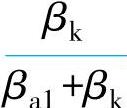 和
和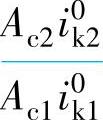 。这两个比值越大,接触腐蚀效应也越大。
。这两个比值越大,接触腐蚀效应也越大。
3)M1、M2上的腐蚀过程都由阴极扩散过程控制时,根据图2-6所示,金属M1、M2上的阴极反应速度都由扩散过程控制,因此阴极反应的电流密度等于极限扩散电流密度id。
在M1、M2接触前ic1=id
在M1、M2接触后

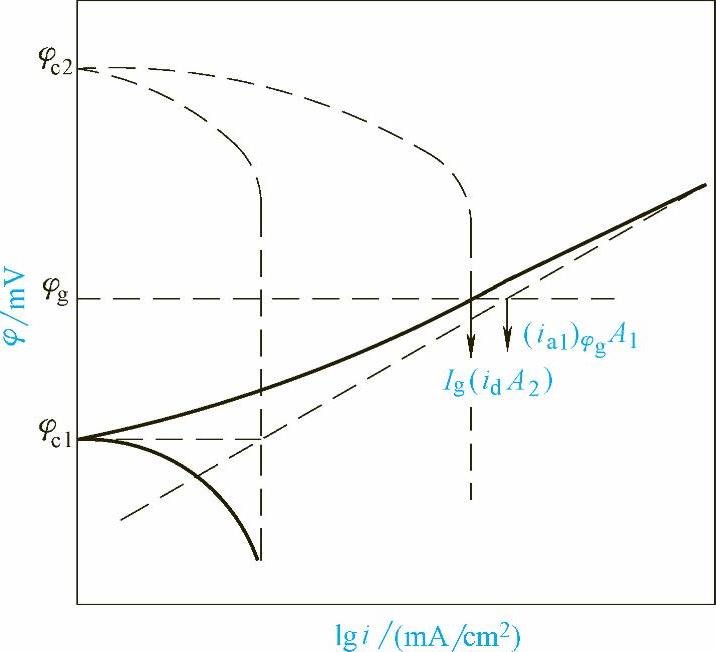
图2-6 接触腐蚀时的极化曲线示意图(三)

根据式(2-16)

所以

在这种情况下,接触腐蚀效应简单地与两种金属的面积比A2/A1呈直线关系。当M2面积很大时,Ac2/Ac1≫1,则

此时,接触腐蚀电偶中阳极溶解速度正比于腐蚀电偶的阴极面积。
4.影响电偶腐蚀的因素
(1)电偶序的影响 电偶序是金属材料在具体腐蚀介质中按腐蚀电位大小排列的顺序。电偶腐蚀的推动力是相互接触材料之间的电位差,电位差越大,电偶腐蚀就越严重。所以,在电偶序中相距越远的材料互相接触,电偶腐蚀就越严重;相距越近的材料接触,发生电偶腐蚀的倾向就越小。
(2)介质的影响
1)介质成分。金属的稳定性因介质成分不同而异,介质成分不同,导致电偶序不同,其结果不仅使腐蚀速度发生明显变化,还可能使金属对发生阴、阳极逆转。例如,Cu-Fe电偶对在中性氯化钠介质中,铁为阳极,若介质中含有NH4+,则铜变为阳极,铁变为阴极。
2)介质的pH值。电解液pH值的变化可能导致电极反应,引起电位的变化,从而改变电偶对的极性,如Mg-Al电偶对在中性或微酸性NaCl溶液中,镁为阳极,铝为阴极,但随着镁不断溶解,溶液变为碱性后,使铝反应成为了阳极。
3)介质的搅拌或流动。搅拌电解液,减轻或消除浓差极化,不仅加速了电偶腐蚀,还可以改变充气状况或金属表面状态,从而改变腐蚀速度以至引起偶极的逆转。
4)介质的电导率。介质的电导率对电偶腐蚀的影响与均匀腐蚀时不同。在均匀腐蚀时,介质的电导率越高,金属的腐蚀速度越大。但在电偶腐蚀时,电导率越高,溶液的IR降越小,有利于电偶腐蚀电流的分散,使阳极的腐蚀分散在较大的面积上,因而损害较小,反而是在电导率较低的介质(如大气或纯水)中,两极间溶液的IR降大,腐蚀集中在离接触点较近的阳极表面上,因而局部腐蚀严重。
(3)温度的影响 温度升高,接触腐蚀电流增大,腐蚀加速。
温度有时还能使电偶对中的金属发生极性逆转。如镀锌铁上的锌镀层在处于室温的中性水或大气中相对于铁基体是阳极,因而优先腐蚀而使铁得到保护,因为此时锌表面生成了一层Zn(OH)2覆盖层,其结构疏松,对锌没有保护作用。但Zn(OH)2在80℃以上的自来水中会脱水而成ZnO,此ZnO对锌有良好的保护作用,因此使锌的腐蚀电位正移,Zn-Fe电偶对发生极性逆转,基体铁变为阳极,腐蚀加速。因此白铁制的水桶不能用来盛沸水。再如处于室温的浓H2SO4中时,钽与高硅铸铁接触时为阴极,但在高于145℃时,极性发生逆转,钽成为阳极。
(4)面积比的影响 接触腐蚀时,大阴极小阳极的面积比能大大促进阳极性金属的腐蚀率。
(5)表面膜的影响 把Al-不锈钢、Al-Cu分别在海水中组成两个电偶对,从表2-7中的电偶序来看,不锈钢与Cu的位置比较接近,因此两个电偶对的电位差应该很接近,因而Al在两个电池中的接触腐蚀倾向应该相似。实际上,在Al-不锈钢电偶对中,Al只受到轻微的腐蚀,但在Al-Cu电偶对中,Al和Cu都遭受到强烈的腐蚀。其原因是,Al-Cu金属的表面上都有高阻耐蚀氧化膜,作为阴极的不锈钢,其表面有很大的IR降,因此阴极还原电流很小,两者的氧化膜都未破坏,所以Al的腐蚀轻微。但在Al-Cu组成的电偶对中,Cu为Al提供了一个强的阴极体,使Al进入过钝化状态,因此Al的腐蚀严重。Cu在海水中生成有Cu2O表面膜,在阴极电流下被还原为Cu而成为裸露的金属,但又不能保护阴极,因此使Cu的自腐蚀速度加快,因而Cu也受到严重的腐蚀。
5.电偶腐蚀的防止
从上面对电偶腐蚀的原理以及对其影响因素的分析,可以采取以下的措施来防止或减缓电偶腐蚀。
(1)合理选材 由于电偶腐蚀的驱动力来自于接触的两种不同金属的电位差,因此组装构件应尽量选择在电偶序中位置靠近的金属相组合。工程设计时,可以参考相应的腐蚀电偶序,若使用的介质没有现成的电偶序,应预先进行必要的实验。
(2)合理的结构设计
1)尽量避免小阳极、大阴极的结构设计。相反,阳极面积大、阴极面积小的结构,往往电偶腐蚀并不显著。
2)在不同金属的连接中要加以绝缘。
3)插入第三种金属。当绝缘设计有困难时,可以在其间插入能降低两种金属间电位差的另一种金属。
4)将阳极部件设计成易于更换的,或适当增厚阳极部件以延长其寿命。如水加热器采用青铜管束和加厚的碳钢管板,比用青铜板在经济上更合理。但在腐蚀性较强的介质中,这种组合是不可取的。
(3)涂料保护层 可以使用非金属涂料保护层进行电偶腐蚀的防护,切不可仅仅涂覆在阳极性金属上,也应把涂料涂覆在阴极性金属上。否则由于涂料的多孔性,必然会组成大阴极、小阳极的电偶组合。
(4)改善腐蚀环境 在允许的条件下,在介质中加入缓蚀剂,或者隔绝、消除阴极去极化剂,减轻介质的腐蚀性。
(5)阴极保护 为抑制电偶腐蚀,可以用外加电流保护法或牺牲阳极保护法对整个设备实行阴极保护。
有关电力系统金属材料防腐与在线修复技术的文章

从各类腐蚀失效事故统计来看,全面腐蚀占17.8%,局部腐蚀占82.2%。其中应力腐蚀断裂为38%,点蚀为25%,缝隙腐蚀为2.2%,晶间腐蚀为11.5%,选择腐蚀为2%,焊缝腐蚀为0.4%,磨蚀等其它腐蚀形式为3.1%。应力腐蚀开裂由机械的因家所产生的腐蚀现象,也称为应力腐蚀,也是局部腐蚀的一个大类。应力腐蚀开裂一般发生在合金中,并与特殊的腐蚀介质联系在一起。应力腐蚀开裂的特点是,大部分表面实际上没有遭到破坏,只有一部分细裂纹穿透金属或者合金内部。......
2023-06-19

韦登斯基效应与韦登斯基易化作用,总称为韦登斯基现象。图2-3-1室性逸搏引起左束支韦登斯基现象男性,36岁,因晕厥入院。韦登斯基现象多发生于房室交界区,也可见于窦房交界区、束支内等部位,偶可见于并行心律的传出传导阻滞中。在某些高度房室传导阻滞和几乎完全性房室传导阻滞病例中,各种类型的逸搏和逸搏心律、韦登斯基易化作用及韦登斯基效应,共同组成防止心室停搏的三种代偿机制,具有重要的临床意义。......
2024-01-08

在国际象棋中子力过载是指:参加战斗的棋子有时担当防御任务,如果一个棋子同时完成两个或更多的功能,那么这个棋子就被认为过载。子力过载现象表面上看这个子在保护某个格子和另外的大子,实际上却经不起战斗的考验,对方就有可能对它所保护的目标实施打击。往往采用一些强制的手段,来诱离、打击过载的保护子。图229图230如图229,黑先:白后同时保护着e4马和a2兵,处于过载状态。......
2023-11-03

周云芳在现实中,有些人频繁跳槽,但总找不准自己的位置。有一位大学毕业生宁童,工作两年已换了六个单位,最近又准备进行第七跳了,说是由于得不到老板的提拔,身边的同事大多不愿和他谈话,他对那份工作一点兴趣也没有了,他想辞职另找一份工作。良久,宁童涨红了脸,终于明白了故事的意思,也明白了自己的弱点所在。只有这样,你才能从根本上解决问题,改变你目前的处境。......
2023-12-06

法律错误指犯罪人误解法律或不知法律的情况。根据这一标准,法律错误应当是尽管采取所有合理措施也无法避免的错误。因此,法律错误的一般标准高于事实错误。法律错误抗辩适用于人工智能系统的重要意义在于,其并不局限于任何形式的法律限制,而且人工智能系统会据此行动。如果先行设计,该系统或许能搜索法律限制条件,但并不一定会有所发现,这便成为适用法律错误一般抗辩的案例。......
2023-07-31

通常情况下,低压触电急救法是指触电者的触电电压低于1000V的急救方法。这种急救法的关键是让触电者迅速脱离电源,然后再进行救治。......
2023-06-22

在六煞星中,以地劫星最不利钱财,有劫财之力,亦会使感情蒙受劫难。地劫星对任何星曜均有不利影响。地劫星座落在财帛宫的第一个害处是破坏同宫之中无论好坏星曜的作用力。因此,地劫星的好处是会同时使宫内其他凶星的凶性不至于过度凸显。若大小限或流年宫逢地劫,且见忌、煞、刑、耗者,主其人在此期间会破财。女命,地劫入命宫者,主其人感情波折,宜晚婚。地劫入疾厄宫地劫入疾厄宫者,其人的四肢有伤。地劫入父母宫参见天空。......
2023-10-29

铝薄膜互连线,需要至少在绝对温度达到1/2的熔点时开始产生电迁移现象。换句话讲,如果物质的浓度场是无源场的话,原子和空位的扩散通量将会均匀分布,则在互连线中也不会发生电迁移现象。如果在某个区域中,它们的分布是十分均匀的,则会有电迁移现象的发生,但并不会有电迁移所导致的损伤出现,其本质原因是其场量是无源的。在接下来的内容中,我们将接着分别讨论微观结构、溶质原子和应力对于焊点的电迁移现象的影响作用。......
2023-06-20
相关推荐