耗量特性曲线上某一点纵坐标和横坐标的比值,即单位时间内输入能量与输出功率之比称作比耗量μ。而当耗量特性纵横坐标单位相同时,它的倒数就是发电设备的效率η。耗量特性曲线上某一点切线的斜率称耗量微增率λ。比耗量和耗量微增率虽通常都有相同的单位,如t/,却是两个不同的概念。这一特殊点m就是从原点作直线与耗量特殊性曲线相切时的切点。显然,在这一点比耗量的数值恰恰最小。比耗量和耗量微增率的变化如图7-6所示。......
2025-09-29
废水中的许多金属离子可以生成氢氧化物沉淀而得以去除。氢氧化物的沉淀与溶液pH有很大关系。如以M(OH)n表示金属氢氧化物,则有:

同时发生水的离解:
![]()
水的离子积为:
![]()
代入式(10-2),取对数得到:
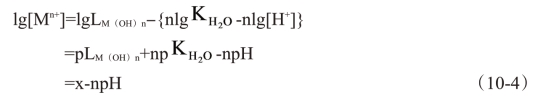 (https://www.chuimin.cn)
(https://www.chuimin.cn)
式中,-lgLM(OH)n=pLM(OH)n;-lg 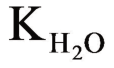 =p
=p 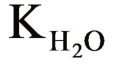 ;x=-pLM(OH)n+np
;x=-pLM(OH)n+np 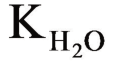 ,对一定的氢氧化物为一常数,见表10-3。
,对一定的氢氧化物为一常数,见表10-3。
表10-3 金属氢氧化物的溶解度与pH的关系表
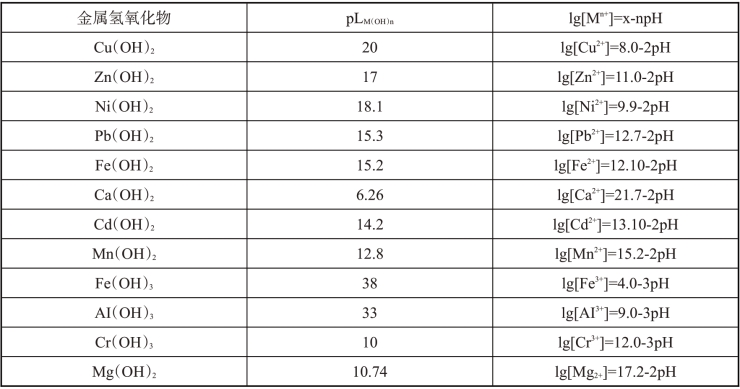
式(10-4)为一直线方程,直线的斜率为-n。由此可知,对于同一价数的金属氢氧化物,它们的斜率相等为平行线;对于不同价数的金属氢氧化物,价数越高,直线越陡,它表明Mn+离子浓度随pH的变化差异比价数低的要大。
由于水的水质比较复杂,实际上氢氧化物在水中的溶解度与pH关系和上述理论计算值有出入,因此沉淀过程的控制条件必须通过试验来确定。
应当指出,有些金属氢氧化物沉淀(例如Zn、Pb、Cr、Sn、Al等)具有两性,既能和酸作用,又能和碱作用。以Zn为例,在pH等于9时,Zn几乎全部以Zn(OH)2的形式沉淀,但是当pH>ll时,生成的Zn(OH)2又能和碱起作用,溶于碱中,生成 或
或 离子,随着pH的增大,
离子,随着pH的增大,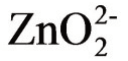 离子浓度呈直线增加。
离子浓度呈直线增加。
综上所述,用氢氧化物法分离水中的重金属时,水中pH是操作的一个重要条件。
相关文章

耗量特性曲线上某一点纵坐标和横坐标的比值,即单位时间内输入能量与输出功率之比称作比耗量μ。而当耗量特性纵横坐标单位相同时,它的倒数就是发电设备的效率η。耗量特性曲线上某一点切线的斜率称耗量微增率λ。比耗量和耗量微增率虽通常都有相同的单位,如t/,却是两个不同的概念。这一特殊点m就是从原点作直线与耗量特殊性曲线相切时的切点。显然,在这一点比耗量的数值恰恰最小。比耗量和耗量微增率的变化如图7-6所示。......
2025-09-29

在50 mL的圆底烧瓶中,加入苯甲醛4.25 g、环戊基甲醚10 mL、1, 3-丙二醇3.35 g和催化剂氯化铵64 mg。将混合物在剧烈搅拌下,用油浴加热,回流6 h。反应完毕,冷至室温。抽滤,将滤液用K2CO3 0.5 g中和,搅拌15 min。过滤,减压下蒸除溶剂,得到黄色油状液体,可进一步通过分馏提纯。AZZENA U, CARRARO M, MAMUYE A D, et al. Cyclopentyl methyl ether-NH4X: a novel solvent/catalyst system for low impact acetalization reactions[J]. Green Chem., 2015,17: 3281-3284.......
2025-09-29

选择动力元件以保证效率最高为原则,也就是使系统在满足负载-速度要求的情况下消耗功率最小。图12-4中的曲线1、2、3就分别是对应三种不同的动力元件参数的伺服阀特性曲线。所有给定工况点应在选定的动力元件输出特性曲线和线之间的区域内。......
2025-09-29

对冗余系统可以进行远程运行、远程停止、远程暂停、远程锁存清除、远程复位等操作,与通信路径无关。对冗余系统进行远程操作的方法有4种:从GX Developer执行的远程操作、MELSEC-NET/H网模块的专用指令进行的远程操作、根据MC协议进行的远程操作、通过EZSocket的OPS进行的远程操作。......
2025-09-29

CM1241 RS232和CM1241 RS485接口模块都支持基于字符的自由口协议,下面以RS232模块为例介绍串口通信模块的端口参数设置、发送参数设置、接收参数设置以及硬件标识符。RS485通信模块没有流控制功能。图8-37 端口参数设置硬流控Hardware RTS always switched通信模块发出TRS请求发送信号后持续检测来自通信伙伴的CTS允许发送信号,以判断通信伙伴是否能接收数据。图8-40 SEND_CFG指令块表8-6 SEND_CFG参数含义3.串口通信模块的接收参数设置在串口通信模块接收数据之前,必须对模块的接收参数进行设置。......
2025-09-29

对塑料粉末火焰喷涂设备的要求1)安全、可靠、不回火,能长时间连续稳定工作。塑料粉末火焰喷涂设备组成 塑料粉末火焰喷涂设备通常由工作气体控制系统、粉系统及喷枪三部分组成。塑料粉末火焰喷涂送粉方式可分为枪上粉筒送粉和专用送粉装置送粉两种。3)喷枪除选用专用火焰喷塑枪外,也可选用多功能粉末火焰喷涂枪。......
2025-09-29

基于此,该项目的主要工作任务是了解机器视觉系统概述、组成等基本知识,了解机器视觉系统在现代工业自动化生产线上的应用。根据任务驱动,培养学生分析问题、解决问题的能力。任务实施根据工业机器人的任务分析,将任务分为二个模块:一是机器视觉系统介绍,二是机器视觉系统的应用。......
2025-09-29
相关推荐