如果把少量石灰和陈醋混在一起,你会发现醋的酸味很快消失了。凡是腐烂的植物,无论树叶、苔藓,还是芦苇、老树干,都会产生一种有一点儿苦味的物质,我们称之为“酸”。酸对植物的生长非常不利。最明显的例子是沼泽地,那里含有的酸性物质就是过量的,非常不适于种植各类农作物,只有无用的芦苇和莎草艰难地生长。石灰恰好能改善这种酸性环境,能在沼泽和潮湿的草甸上创造奇迹。......
2023-10-21
花粉进入柱头后,在花柱中的生长除了传输通道中营养物质的供给外,还受到从花柱到胚珠梯度分布化学信号及其他信号物质的指引。花粉管在花柱中的生长不仅受传输管道环境本身的影响,也受来自于胚珠的信号指引(图5.10)。这种引导作用有长距离和短距离的指引。
1.长距离指引
花柱可分为开放、封闭、半封闭三类。在开放花柱中,许多单子叶植物如百合,花粉管沿着传输管道表皮,在充满黏液的管道中生长。多数双子叶植物花柱封闭,花粉管在与柱头分泌区连续的传输管道组织(transmitting tissue)中生长。传输管道组织的细胞列由横向壁上胞间连丝相连,纵向壁被细胞间基质(IM)分离。化学分析表明IM成分有游离糖类、多糖、游离氨基酸、蛋白、糖蛋白、酚类化合物,它们可能对花粉管的生长起着营养、识别和指导作用。在这种基质中花粉管生长速度很快(图5.11,Lord,2003)。
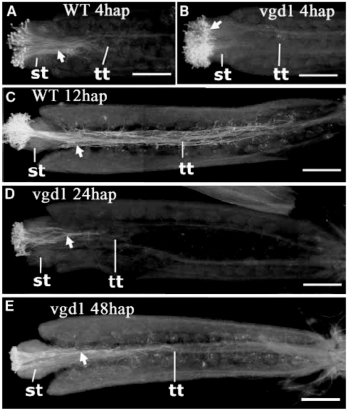
图5.9 花粉果胶甲脂酶突变对花粉管生长的影响(Jiang et al.,2005,ⓒASPB)
图5.10 拟南芥胚珠对花粉管吸引的示意图
a.胚珠指引花粉管生长方向;b.胚珠内因素吸引沿珠柄生长的花粉管转弯进入珠孔(Palanivelu and Preuss,2006,ⓒBMC Plant Biol.)
花粉管通过花柱中传输组织进入雌蕊并生长延伸。花柱中的传输组织细胞间分泌的有糖类、蛋白类(如羟脯糖蛋白HRGPs、阿拉伯半乳糖蛋白AGPs),这些物质作为花粉生长的营养物质和引导花粉生长方向的作用。烟草传输通道专一的(transmitting tissue-specific,TTS)糖蛋白也是一种AGPs,与细胞间基质紧密结合,从顶部到胚珠糖基化程度增高,酸性增高,在传输通道中建立了化学浓度梯度,花粉管在体外有去糖基化的作用,因此,AGP在传输通道中的分布可能为花粉管提供糖分子,对生长的花粉管具有引导作用。富含半乳糖花柱糖蛋白(galactose-rich style glycoprotein,GaRSGP)、120 kU糖蛋白、雌蕊专一的类伸展蛋白(pistil-specific extensin-like protein,PELP)不具糖基化梯度作用。GaRSGP位于传输组织细胞壁上。120 kU糖蛋白位于IM然后进入花粉细胞质。PELPⅢ先在IM然后到花粉管细胞壁上,最后转移到胼胝质塞上。大分子转运通过花粉细胞壁可能是SRnase决定自交不亲和的原因之一。已经发现S-Rnase与TTS和NaPELPⅢ糖蛋白形成复合物。SCA/果胶组合提供附着基质,在接触或络合刺激中起着引导花粉管的作用(Edlund et al.,2004;Hiscock and Allen,2008)。

图5.11 花粉管生长途径(Kandasamy et al.,1990;Gasser and Robinson-Beers,1993,ⓒASPB)
几种植物雌蕊内部结构,传输组织是花粉管生长途径,为柱头表面萌发的花粉管进入管道定向生长提供必需的机械引导。
雌蕊专一的类伸展蛋白PELPⅢ在细胞间基质(IM)积累,转移到花粉管壁上,主要分布在花粉管胼胝质壁上(cw)。这种PELPⅢ在授粉后的花柱花粉管壁的横向和纵向切片中都存在(Sanchez et al.,2004)。
四碳氨基酸伽马氨基丁酸(γ-amino butyric acid,GABA)在拟南芥从柱头到胚珠浓度分布呈梯度增加,柱头浓度为20 μmol/L,花柱中为60 μmol/L,子房壁为110 μmol/L,子房室的隔膜表面为160 μmol/L,完整的胚珠和胚柄含30 μmol/L,然而胚珠内的GABA可能集中在内珠被,浓度达500 μmol/L(Palanivelu et al.,2003)。花粉管中的GABA转氨酶可以分解GABA,对花粉管在花柱中的生长是必需的,说明从柱头到胚珠内的GABA浓度梯度对花粉管进入胚珠是一个重要方向因素(Palanivelu et al.,2003)。GABA对花粉管的指引属于长距离指引。
γ-氨基丁酸GABA(g-amino butyric acid)在体外促进花粉管生长,过量则抑制花粉管生长。Pollen Pistil 2(POP2)编码γ-氨基丁酸转氨酶。将GABA分解为琥珀半醛,然后氧化成为琥珀酸,放出NADH(图5.12)。野生型未授粉雌蕊在花柱中积累低水平的GABA,从柱头经花柱到子房室量浓度梯度增加,为花粉管生长提供GABA梯度。同时也为花粉管生长提供能量和营养物质。在pop2突变体中,GABA没有降解,甚至比野生型积累更高水平。野生型花粉管在pop2花柱中正常生长,但pop2花粉管在突变雌蕊中不能生长(Palanivelu et al.,2003)。说明花粉管的POP2决定GABA的利用。
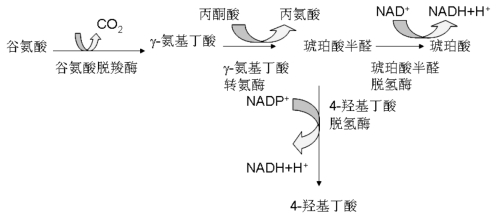
图5.12 POP2对GABA的分解作用(Palanivelu et al.,2003)
NO是指导花粉管生长并进入胚珠的另一个信号。体外花粉管内的过氧化物酶体形成NO,通过花粉管内的cGMP途径抑制生长而调节花粉管生长,花粉管释放NO处与花柱接触面的活性氧消失(Prado et al.,2004;Hiscock and Allen,2008)。然而NO信号传导突变体Atnos1花粉可以在野生型雌蕊中正常生长,反之花粉管生长异常。说明花柱中引导花粉生长的NO信号是雌蕊产生的,NO不对称分布在珠孔周围,花粉管从没有NO的区域生长进入珠孔。去除NO的试剂可以引起花粉管极性改变,D-Ser可增加Ca2+输入花粉管,从而引起花粉管极性变化,用D-Ser处理可以恢复NO缺乏引起的花粉管极性异常。说明NO信号介导Ca信号系统控制的花粉管生长,负调控花粉管生长方向(Prado et al.,2004;2008)。
烟草的柱头是湿柱头,实心花柱,花粉管生长穿过分泌区域细胞的细胞间空间,内有分泌细胞的排出物。排出物具有疏松细胞壁活性。排出物中雌蕊花粉过敏样蛋白(PPAL)与β-expansins高度相似,可能作为细胞壁疏松活性物质帮助花粉管长入烟草柱头。但PPAL在体外膨胀计分析没有细胞壁疏松活性。脂类转移蛋白(LTP),烟草排出物中最丰富的蛋白可在体外结合酰基脂类。脂类可能在花粉管生长导向中起重要作用。LTPs组成拟南芥涉及脂代谢基因中最大一组,可能有不同的功能。花药贡献的非专一性LTPs和分泌的其他蛋白防御病原菌。蛋白酶抑制剂、thaumatin-like proteins以及其他防御相关蛋白在Solanaceae豆科植物的柱头表达和积累,可能防止动物或病原菌(Sanchez et al.,2004)。
LTP(-like)蛋白、SCA蛋白(stigma/stylar Cys-rich adhesin)分泌到百合水相中,SCA与其他小柱头蛋白和chemocyanin一起对百合花粉诱导向化活性.(Sanchez,et al.,2004)。
2.短距离指引
在花粉管生长到胚珠附近,即第三和第四阶段时,需要胚珠内的信号指引,这时的指引属于短距离信号指引。第三阶段花粉管沿着隔膜向胚柄生长,第四阶段沿着胚柄向珠孔生长。
在第二阶段以后花粉管在花柱中有与胚珠发育阶段相适应的间歇生长,说明胚珠发出的信号指导花粉管的生长。(www.chuimin.cn)
已进入胚珠的花粉管的排斥负调控是一种控制花粉管的生长方向的因素(图5.13)。这种方向指引作用在胚珠附近发生,属于短距离作用(Palanivelu and Preuss,2006)。
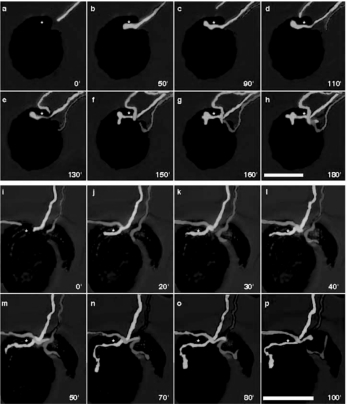
图5.13 花粉管避免标定的胚珠
三个花粉管竞争一个胚珠(a-p)。绿花粉管进入珠孔,粉色和红色迟到的花粉管没有进入。时间进程分钟。标线100μm(Palanivelu and Preuss,2006)
胚珠中中心细胞编码N端为锌β带保守区域的核蛋白CCG的表达也决定花粉管生长的方向。突变体花粉管不能进入珠孔。CCGN端保守区域是普通转录因子TFⅡB和TFⅢB家族具有的序列,在基因表达调控中起重要作用。突变体胚囊细胞类型不受影响,在突变体中心细胞特异表达转基因的CCG恢复对花粉管的引导作用(图5.14)(Chen et al.,2007)。
NO信号在花粉管在珠孔附近的转弯过程中发挥重要作用(Prado et al.,2004;2008)。GABA也一直在引导花粉管方向时起作用,包括短距离的信号作用。
MYB98是R2R3MYB基因家族的转录因子,正调控一系列基因在助细胞的特异表达,决定助细胞的分化。myb98突变体花粉管失去进入珠孔的方向指导。助细胞是吸引花粉管生长的一个主要信号来源(Marton et al.,2005),细胞壁加厚有装饰,形成纤维状装置(filliform apparatus,fa),有许多指状突起伸入助细胞胞质内,myb98突变体的助细胞纤维状装置指状突起缺失,它调控一系列位于助细胞纤维状装置指状突起蛋白的表达,说明助细胞纤维状装置指状突起与花粉管的珠孔定向有关(Kasahara et al.,2005;Punwani et al.,2007)。
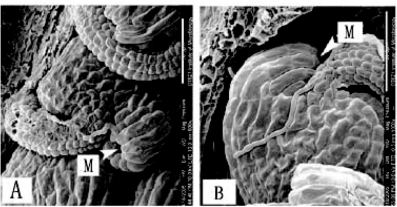
图5.14 CCG决定花粉管进入珠孔
A.野生型花粉管进入珠孔(M)。B.ccg突变体花粉管错过珠孔(Chen et al.,2007,ⓒASPB)
其他来自助细胞的引导信号调控还有ZmEA1、LURE1、LURE2,感受花粉管的调控有受体样激酶SRN/FER、ANX1、ANX2、钙泵ACA9、蛋白LRE、NTA、SYL、AMC、ZmES4(Kawashima and Berger,2011)。
MAGATAMA3(MAA3)编码818个氨基酸的蛋白,含有DEAD解旋酶区域,在花、角果、根叶、茎顶端表达水平相似,突变体雌配子体发育延迟,极核核仁很小,花粉管到珠孔的定向缺失。MAA3与酵母的SEN1(splicing endonuclease1)相似,SEN1对各种RNA代谢是必需的,突变体中出现小核RNA(small nuclear RNA,snoRNA)和rRNA的处理缺陷。小核仁的maa3突变体可能有同样的情况。大规模的基因表达缺失影响胚囊内各类细胞信号的形成,从而导致对花粉管方向决定的丧失(Shimizu.et al.,2008)。
3.花粉管进入胚囊后的变化
助细胞位于珠孔处,面向珠孔的一端有纤维状装置(fa),向胞质内形成指状突起。助细胞具有吸引花粉管的作用。花粉管进入珠孔后马上进入其中一个助细胞,停止生长,破裂并释放内含物。纤维状装置具有接受花粉管的特殊功能。助细胞内的物质具有促进花粉管破裂、释放精子的作用。对雌配子体发育和助细胞基因组水平的研究揭示了一些决定助细胞分化的重要基因和助细胞特异表达的基因。这些基因有防卫基因、蛋白质、富含半胱氨酸的基因、MYB98转录因子、外被蛋白、DNA糖基化酶、半乳糖基转移酶、多聚半乳糖醛酸酶、自交不亲和相关蛋白、碱化蛋白、质体蓝素等。助细胞本身是极化的细胞,细胞核(sn)、细胞质位于珠孔端,富含各种细胞器,大液泡(sv)位于反足细胞端。面向合点端的细胞壁缺失或不连续。这种不连续可能为精子通向卵细胞和中心细胞提供通道(图5.15)(Kasahara et al.,2005;Punwani and Drews,2008)。
拟南芥雌蕊传输管道中心特异分布AGPs,胚珠内大孢子表面也布满大量AGP,随着胚珠的继续发育,胚囊表面细胞壁有两种AGP抗体结合的AGP分布,在助细胞和它们的纤维状装置上尤为密集。抗体JIM8和JIM13标记的AGP延伸分布到珠孔处的内珠被,显示对花粉管的吸引。抗体MAC207和LM2标记的AGP在大孢子发生和雌配子体发生的各种细胞类型都有分布,但胚囊中没有,说明吸引花粉管的是JIM8和JIM13标记的AGP(Coimbra.et al.,2007)。

图5.15 助细胞极性结构(Kasahara et al.,2005,ⓒASPB)
sc-助细胞,sv-助细胞液泡,sn-助细胞核,fa-纤维状装置,en-卵细胞核,ev-卵细胞液泡
有些观察显示花粉管在助细胞间停止生长,释放精子,也许不同的物种或条件不同现象不同,这些需要进一步研究。编码钙泵的花粉ACA9基因也在花粉管生长停止和精子释放过程中起重要作用(Punwani and Drews,2008)。
花粉管进入助细胞后或前,诱导助细胞程序化死亡。不同物种中诱导助细胞程序化死亡的时间不同。FER基因和GFA2基因影响花粉管诱导的助细胞程序化死亡。FER基因编码一个受体激酶,可能是花粉管助细胞最后作用的信号传导途径。GFA2基因是线粒体功能必需的J区域蛋白,说明程序化死亡需要线粒体的功能(Punwani and Drews,2008;Rotman et al.,2003;Christensen et al.,2002;Escobar-Restrepo et al.,2007)。
在程序化死亡的助细胞到卵细胞和中心细胞之间有肌动蛋白冠形成并连接,释放后的精子沿着肌动蛋白细胞骨架迁移到目标。精子与目标细胞的融合可能也需要降解的助细胞帮助。助细胞液泡中钙浓度很高,助细胞降解造成配子体中高浓度钙离子,为细胞融合提供有利条件。助细胞降解本身为精子无障碍地自由在配子体中运动提供了便利(Punwani and Drews,2008)。
阿拉伯半乳糖蛋白(arabinogalactan proteins,AGPs)在受精前后的卵细胞细胞膜、细胞壁、细胞质中存在,两细胞前胚的细胞质和液泡中也存在。受精前卵细胞AGP含量很高,受精后AGP含量迅速降低,AGP抑制剂βGlcY处理使卵细胞受精停止,但中心细胞受精不受影响,说明AGP影响合子形成(Qin and Zhao,2006)。
有关植物发育生物学的文章

如果把少量石灰和陈醋混在一起,你会发现醋的酸味很快消失了。凡是腐烂的植物,无论树叶、苔藓,还是芦苇、老树干,都会产生一种有一点儿苦味的物质,我们称之为“酸”。酸对植物的生长非常不利。最明显的例子是沼泽地,那里含有的酸性物质就是过量的,非常不适于种植各类农作物,只有无用的芦苇和莎草艰难地生长。石灰恰好能改善这种酸性环境,能在沼泽和潮湿的草甸上创造奇迹。......
2023-10-21

甘松性凉、轻,在兽医临床中多用于治疗“热毒泻”“瘟疫症”,其在抗菌消炎、治疗消化系统疾病和传染性疾病方面都有作用。以甘松、草乌叶、瞿麦、多叶棘豆等药材制成巴布-7蒙药复方,可压制疼痛,除热止痢,有效杀灭致犊牛腹泻的大肠杆菌[44]。以甘松和银朱各一钱半,冰片、甘草、白芍各一钱,诃子、草乌叶各五钱,病猪温水灌服,连续3日可清热解毒、涩肠止泻[47]。家畜误食霉草中毒,排黑色粪便。......
2023-11-23

在“翻转”后的思想政治课堂上,教师一味讲授的时间减少,教师和学生将有更多的时间用于教学互动,从而在互动过程中培养学生良好的思想情感,具体可从以下几方面进行。思想政治翻转课堂在课前完成了知识的传授阶段,课上有更多的时间用于组织教学活动、课堂实践,而且在课后环节强调了“实践应用”。......
2023-08-15

显然风险控制是供应链融资成功实施的关键。将物联网技术引入供应链金融业务后,虽然不能从根本上解决企业文化差异带来的风险,但是通过物联网信息系统的建立,可以有效地构建供应链上企业间的长期稳定合作关系,在建立物联网信息系统的同时就业务流程上的不同看法进行协调,拟定长期稳定的合作标准,从而减少由于企业文化不同引起文化差异风险的可能性。......
2023-08-13

头脑风暴法也是我国企业普遍应用的预测方法。因此,头脑风暴法产生的结果,应当认为是专家组集体创造的成果,是这个宏观智能结构的总体效应。......
2023-07-15

在贴近学生生活兴趣的情境创设下,学生对课堂活动的参与程度较高,真实的审美体验油然而生。(二)身体律动:审美体验最直接的表达形式在激趣探究部分,笔者用动物名称代替四种节奏型名称。即兴创造并不只是培养创造力,更多的是体现学生在审美体验中的自主性。可见,在创造中,他们独特的审美体验得到了释放。同时,学生也能将音乐中获得的审美体验融......
2023-07-04

在Power Point中创建动画效果可以使用预设动画和自定义动画。当对设置的动画效果不满意时,可以在“动画”窗格中的动画列表中右击某一对象的动画效果,然后在弹出的快捷菜单中选择“删除”选项即可,剩下的其他动画效果自动排序。默认情况下,动画效果按照创建顺序进行编号。利用自定义动画功能为幻灯片中的各个对象创建动画效果,设置动画的开始、速度及属性,控制好动画效果发生的先后顺序等环节。......
2023-11-20
相关推荐