乳中钙磷等盐类的构成及其状态对乳的物理化学性质有很大影响,乳品加工中盐类的平衡成为重要问题。乳中的铜、铁对储藏中的乳制品有促进其发生异常气味的作用。乳中的矿物质大部分与有机酸和无机酸结合,以可溶性的盐类状态存在。......
2025-09-29
1.水溶液中的离子
天然水中的溶解物质大部分是强电解质,在水中以离子的形式存在。
在水溶液中,离子之间存在着相互作用。由于热运动离子趋向无序状态,但是离子之间的库仑力又使离子的分布趋于有序状态。在稀溶液(如天然淡水)中,由于离子与离子之间的距离较大,库仑力小,离子的分布近于无序运动;在浓溶液(如海水)中,可将它们作为部分有序对待。
德拜等人研究了完全解离的强电解质稀溶液中的离子分布。在远离中心离子的地方,同号与反号两种离子的几率相等,呈现无秩序排列;但在接近中心离子处,反号离子的几率则增加,这样中心离子被反号离子所包围,构成了“离子氛”。离子氛中总剩余电荷应等于中心离子的电荷,使整个溶液保持为电中性。例如,水溶液中含有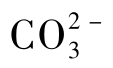 和
和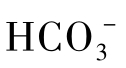 离子时,Ca2+离子将与周围的
离子时,Ca2+离子将与周围的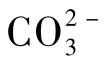 或
或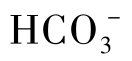 构成的离子氛如图1-16所示。
构成的离子氛如图1-16所示。
从中心离子向外,电荷密度按照指数规律随距离增加而衰减,从理论上来说到达无限远处电荷密度才为0,即离子氛的范围是无限大的。但实际上,离子氛是有厚度的。设离子氛的半径为1/к,则1/к的计算公式为:
图1-16 Ca2+与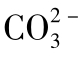 或
或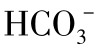 构成的离子氛示意图
构成的离子氛示意图
式中 c——溶液中电解质的摩尔浓度,mol/L
μi——i离子的浓度(单位体积溶液离子与溶质的摩尔比)
zi——单个离子所带电荷数
∑ ——溶液中各种离子的求和
离子氛半径代表中心离子静电场强度的作用范围,离子氛半径1/к值与溶液中各种离子的浓度和电荷有关。
对浓度小于0.1mol/L的溶液,理论上推导出来的热力学量与实验数据一致,一般认为这是稀溶液的界线,显然,天然淡水属于稀溶液的范畴。
在含盐量为35‰的海水中,每千克含有6.75×1023个离子,相当于在半径为0.7nm的球形范围内存在一个离子。将其与图1-13所示的中心离子周围B区域外缘的半径0.6nm相比可以看出,在海水中,只有1/3的水分子具有普通水的结构。
如果水溶液的浓度达到1mol/L以上,则各个离子B区域的水将重合,也就是说,这种状态的水溶液其实已经接近溶融盐了。
在0.1~1mol/L的中等浓度溶液中,离子间的相互作用变大。贝耶伦(N.Bjerrum)研究了在正负离子间有库仑力作用而生成离子对的情况。据计算结果,离子在溶液中的分布情况如图1-17所示。
图1-17 离子间的径向分布函数1∶1电解质水溶液,25℃
图1-17中,纵轴表示每千克溶液中某种离子的浓度,横轴为离子间距离。可见,同号离子随着距中心离子距离(r)的增加而增加。异号离子在径向分布上存在着极小值的区段,极小值区段距中心离子的距离(q)称为贝耶伦距离。贝耶伦认为,当r<q时,异号离子与中心离子缔合形成离子对;而当r>q时,不存在离子的缔合。
贝耶伦缔合理论仅考虑了正负离子间存在着静电力作用,实际上,离子之间还存在着距离的量子力学作用、离子与溶剂之间的相互作用、溶剂化范围的重合等。再有,中心离子与特定的配位体可生成络离子。因此,有人建议将溶液中由于配位体结合的称为络离子,将由于库仑力结合的称为离子对。
对电解质水溶液中的离子状态,近年来还存在着另一种认识,认为在水溶液中,食盐完全解离成Na+和Cl-,不仅是由于“离子晶体”的影响,更主要的是受水是强极性溶剂的影响。而在弱极性溶剂中Na+与Cl-也可以再缔合。
2.离子的活度和强度
对于天然水这样的强电解质溶液,离子的运动必然会受到其周围离子氛中反号离子的吸引,对其运动产生牵制作用,使离子的活性降低,使化学反应相应有所减缓。表面看来,似是离子的数目减少了,即离子的浓度降低了,或者说,有一部分离子浓度在化学反应中不起作用了。此时如果用原来的溶液浓度进行化学计算,就会出现一定程度的偏差,为保证计算的精度,必须对溶液的离子浓度进行校正。校正后的浓度即成为离子的有效浓度,又称离子的活度。实际上溶液中的各分子也存在着相互作用,只是其相互作用的程度比离子要低。
离子或分子的活度即有效浓度,是真实浓度的函数,一般情况下要小于真实浓度,若用a表示活度,则活度a与浓度c只差一校正系数f,即:
校正系数f称活度系数,代表有效浓度对真实浓度的比值,一般情况下小于1,对于无限稀释的溶液,其活度将趋向于浓度:
相应有:
活度是离子的一种特性。同一种离子不论它们来自何种电解质,在相同条件下都有同一活度。
各种不同离子的活度并不完全一样,目前尚无法测定某一种离子的活度。实际测得的都是包括阳离子和阴离子的某种电解质的活动能力,称为该种电解质的平均离子活度,以a±表示,而其阳离子活度为a+、阴离子活度a-。于是对1:1价型电解质,如NaCl有:
同样可得平均离子活度系数为:
虽然没有方法直接测定每种离子的活度系数,但可以利用计算方法从平均活度系数近似地求得某些离子活度系数值。例如,K+和Cl-的电子层结构和离子半径十分相似,可以设想这两种离子的活度系数相等:
离子活度和活度系数值随溶液中离子的浓度而变化。
当溶液中同时存在多种离子时,每种离子的活度都受到其中各种离子的影响。实际研究发现,这时对离子活度产生影响的不只是各种离子的浓度,而且有各种离子的电荷值。实际上,离子活度同溶液中全部离子的电荷总量有关系,而与离子的种类关系不大。
根据这一特性,提出溶液的离子强度的概念,定义为:
式中 I——溶液的离子强度
Ci——溶液中第i种离子的浓度
Zi——电荷值即离子价
离子强度是某一溶液整体的特征值,代表了全部离子的浓度和电荷值两种因素,总体反应出溶液中各种离子对其中一种离子的活度所产生影响的强弱程度。定义中的电荷为平方值,是因为二价离子之间的静电作用是一价离子之间作用强度的4倍。
对于1∶1价型电解质:
即溶液的离子强度等于其摩尔浓度。
对于1∶2或2∶1价型电解质:
对于2∶2价型电解质则有:
根据实际情况得出一条规律,即在稀溶液中,离子的活度系数只与该溶液的离子强度有关,而与各种离子的种类无关。
另外,同一离子强度下,价数相同的各种离子有着比较相近的活度系数,可以近似地认为具有同一数值,这个规则可准确保持到I=0.02以前,并在I=0.2时也可以应用,见表1-6。
表1-6 不同离子强度溶液中离子的活度系数(f)
由强电解质理论也可推导出离子活度系数的计算式。在实用上,都采用简化的近似式,应用于较稀的溶液,如:
式(1-26)可适用的离子强度最高可为0.5。
若离子强度最高为0.1时,可用以下简化式:
当离子强度在0.001左右时还可进一步简化为:
一般天然淡水可采用式(1-29)计算离子强度:
式中 C——水中溶解性固体总量,即含盐量值,mg/L
海水的离子强度很高,约为0.67。可以用下式求海水的离子强度:
式中 SCl——氯离子含量,‰
对含盐量(S)为35‰左右的海水,可以写成:
在式(1-31)中假定所有离子都处于游离状态。但海水中的主要成分有相当一部分形成了离子对。因此考虑到这一点,上式变成:
考虑离子对时所计算出的离子强度要比未考虑离子对时所计算出的离子强度低。
3.天然水的酸度
水的酸度指水中所含能与强碱发生中和作用的物质的总量,即能放出质子H+或经水解能产生H+的物质的量。组成水中的酸度的物质可以归纳为以下三类:
(1)强酸,如HCl、H2SO4,HNO3等。(https://www.chuimin.cn)
(2)弱酸,如CO2、H2CO3、H4SiO4、H2S以及各种有机酸类。
(3)强酸弱碱盐,如FeCl3、Al2(SO4)3等。
大多数天然水只含有弱酸(主要是碳酸)。这些物质在水中都会电离产生H+或经过水解产生H+,而这些H+均能与OH-发生中和反应。这些H+的总数称为总酸度。
总酸度与水中的H+浓度不是一回事,pH表示呈离子状态的H+的数量,pH是水中氢离子平衡浓度的负对数,即:
总酸度:总酸度表示中和过程中可以与强碱进行反应的全部H+的数量,其中包括已经电离的和即将电离的两部分。
离子酸度(或活性酸度):在中和前溶液中已经电离产生的H+(实际上是水合质子:H3O+)数量称为离子酸度(或活性酸度),其lg[H+]就是水的pH。强酸在溶液中全部电离,所以由它构成的酸度都是离子酸度。
分子酸度或后备酸度(或潜在酸度):酸度的分子只有一部分电离,大部分在中和前呈分子状态,在中和过程中陆续电离参与反应。这部分在中和前未电离的H+的数量称为分子酸度或后备酸度,或潜在酸度。
因此弱酸构成的酸度由离子酸度和后备酸度两部分组成,溶液的pH只代表其离子酸度。例如:
强酸弱碱盐的水解会使溶液中产生离子酸度,其未水解部分则构成后备酸度。在中和过程中逐步水解参加中和反应,直到全部水解完毕为止。例如:
在研究水的酸度时,除了解总酸度外,有时还分别测定强酸度和游离碳酸度。强酸酸度也称为无极酸度。当溶液中存在微量强酸时,其pH一般低于4。在水中的pH高于4时,其酸度一般由弱酸构成。如前所述,在大多数天然水由碳酸构成。游离碳酸的含量包括CO2和H2CO3的含量。
酸度的单位常用mmol/L表示。游离碳酸单位有时也采用CO2mg/L表示,有些国家也常采用与硬度相同的单位来表示,即把酸度折合为CaCO3或CaO的mg/L表示,并把10mg/L称为1度。这样,1mmol/L的酸度相当于50mg/L的CaO,折合为2.8度(德国度)。
天然水受到强酸污染时,其pH均在4以下。而当水的pH高于4时,水的酸度一般都由弱酸构成。如果天然水未受到工业弱酸的污染,则弱酸主要指碳酸。
4.天然水的碱度
(1)天然水的碱度 与酸度相反,碱度是指水中所含的能与强酸发生中和作用的全部物质,即能接受质子H+的物质总量。组成水中碱度的物质也可归纳为三类。
①强碱,如NaOH、Ca(OH)2等,在溶液中全部电离生成OH-离子。
②弱碱,如NH3、C6H8、NH2等有机胺类。在水中有一部分发生反应生成OH-。
③强碱弱酸盐,如各种碳酸盐、重碳酸盐、硅酸盐、磷酸盐、硫化物、腐殖酸盐等。
在水解生成OH-或者直接接受质子H+,如有些碱性物质可直接与H+起中和反应,如:
天然水的碱度是由氢氧化物、碳酸盐和重碳酸盐成分构成的。按离子状态可把天然水中的碱度分为三类:①氢氧化物碱度,即OH-离子含量;②碳酸盐碱度,即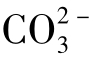 离子含量;③重碳酸盐碱度,即
离子含量;③重碳酸盐碱度,即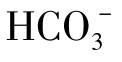 含量。
含量。
碱度是用酸滴定法测定的。以甲基橙为指示剂测得的碱度是水中全部碳酸盐和氢氧化物,故称为全碱度(简称碱度)或甲基橙碱度(M);用酚酞为指示剂测得的碱度,称为酚酞碱度(P),它表示氢氧化物和碳酸盐的一半。
大多数天然水中,碱度由氢氧化物、碳酸盐和重碳酸盐组成,通常称为总碱度,以M表示,故:
天然水中溶有微量强碱或碳酸盐水解时,均会使水的pH升高到10以上,因此氢氧化物碱度的实际存在范围是在pH>10。
天然水的pH一般均低于10,故水中总碱度实际上由碳酸盐和重碳酸盐所组成。当水的pH小于10而大于8.3时,则:
在有 存在时就同时有
存在时就同时有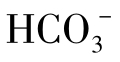 存在,不过到pH>10以后,
存在,不过到pH>10以后,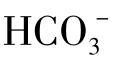 迅速减少。当水的pH小于8.3而大于4.5时,则是碳酸盐碱度的存在范围:
迅速减少。当水的pH小于8.3而大于4.5时,则是碳酸盐碱度的存在范围:
pH降到8.3时,可以认为水中只存在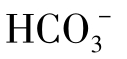 ,再继续降低,则转化为H2CO3,直到pH4.5全部转化完毕。当水的pH小于4.5时,则M趋于零。
,再继续降低,则转化为H2CO3,直到pH4.5全部转化完毕。当水的pH小于4.5时,则M趋于零。
微量的强碱会使溶液中pH升高到10以上,因此氢氧化物碱度的实际存在范围是pH>10时,这时水的总碱度常由氢氧化物和碳酸盐组成,即:
如果天然水中有大量藻类繁殖,在繁殖过程中会吸收水中CO2,使水的pH迅速升高,这时水中总碱度主要由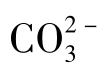 组成。
组成。
在确定碱度类型时做了一项假设,认为氢氧化物和重碳酸盐两种碱度不能共存,因为在pH高时,下列反应会强烈地向右进行:
根据这一假设,水的碱度可能有5种不同组合类型:①单独的OH-;②OH-+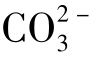 ;③单独的
;③单独的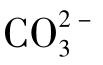 ;④
;④ +
+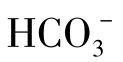 ;⑤单独的
;⑤单独的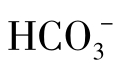 。
。
根据化学平衡计算,在OH-、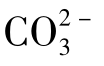 与
与 碱度之间存在着固定的数值关系。实际工作中根据所测得的溶液的总碱度和可以计算出三种碱度的数值。
碱度之间存在着固定的数值关系。实际工作中根据所测得的溶液的总碱度和可以计算出三种碱度的数值。
根据碳酸平衡规律,可以分析在不同的pH的水中可能存在的碱度类型。
(2)碱度的单位 碱度的单位为mmol/L。此时基本单元为H+。此外,也有用mg/L CaCO3来表示的:
(3)天然水的碱度分级 水按碱度划分可分为极高碱度水、高碱度水、中碱度水、低碱度水和极低碱度水五类,见表1-7。
表1-7 水按碱度的分类
5.天然水的硬度
(1)天然水的硬度所谓硬水是指洗涤时肥皂不易起泡沫、在加热时易生成水垢的水。这种现象的产生与天然水中某些阳离子,如Ca2+、Mg2+、Fe2+、Mn2+、Sr2+、Fe3+、Al3+易生成难溶盐类有关。由于天然水中最主要的阳离子是Ca2+与Mg2+,其他离子在水中含量很少,一般常以Ca2+和Mg2+的含量来计算水的硬度,并作为水质的一个指标。天然水都含有一定的硬度,地下水、咸水和海水的硬度较大。
硬水不适于工业上使用,当水被加热时,其中钙、镁离子将同重碳酸根起作用,生成碳酸钙和氢氧化镁等难溶化合物,沉积在加热壁上生成水垢,如:
水垢也给人的日常生活带来不便。在日用水及纺织洗染工业用水中,硬度会浪费肥皂,降低产品质量。肥皂的主要成分是脂肪酸的钠盐,钠盐在水中溶解成为离子,例如:
脂肪酸根如C17H35COO-等是一种二亲分子,称为表面活性物质,具有胶溶除垢的洗涤作用。若水中含有较多钙、镁离子,将生成难溶沉淀物,例如:
这些钙盐、镁盐都不溶于水,不但不起除垢作用,而且会粘附在纤维上产生更多污垢。
(2)碳酸盐硬度与非碳酸盐硬度水中所含钙、镁离子总量称为水的总硬度,总硬度又可进一步分为钙硬度和镁硬度。
根据假想化合物的原理,考虑水中的阴离子组成,又可把硬度区分为碳酸盐硬度和非碳酸盐硬度。
碳酸盐硬度就是钙和镁的重碳酸盐和碳酸盐,由于钙、镁离子在水中往往先生成碳酸盐沉淀,人们把硬度首先看作是碳酸盐硬度,这种硬度在水煮沸后很容易成为碳酸盐析出,所以又称为暂时硬度。碳酸盐以外的硬度盐类,如钙、镁的硫酸盐、氯化物等,称为非碳酸盐硬度。用一般煮沸的方法不能把它们从水中除去,所以又称为永久硬度。
上述分类方法只是反映水中钙、镁离子同阴离子组成间的数量对比关系,不可机械地认为水中固定地含有这些盐类。
根据硬度和阴离子的对比关系可以把水的硬度分为总硬度大于总碱度和总硬度小于总碱度两种情况。其假想化合物如图1-18所示。
图1-18 硬度的组成
图1-18(1)中表示水的总硬度大于总碱度,有:
天然水的pH一般均在8.3以下,因此水中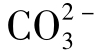 的含量极少,可以认为天然水中碳酸盐硬度的阴离子就是[
的含量极少,可以认为天然水中碳酸盐硬度的阴离子就是[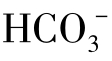 ],此阴离子就是水的总碱度。此时水中的碳酸盐硬度就等于总碱度,即图1-18(1)中a=[
],此阴离子就是水的总碱度。此时水中的碳酸盐硬度就等于总碱度,即图1-18(1)中a=[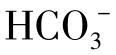 ]。另外,水中还含有非碳酸盐硬度,其值为总硬度与总碱度之差,即为图中b=[Ca2+]+[Mg2+]-[
]。另外,水中还含有非碳酸盐硬度,其值为总硬度与总碱度之差,即为图中b=[Ca2+]+[Mg2+]-[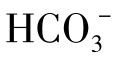 ]。
]。
图1-18(2)中,表示水的总硬度小于总碱度,有:
此时可以认为水中的全部硬度都是碳酸盐硬度。在图1-18(2)中,a=[Ca2++Mg2+]。这时水中没有非碳酸盐硬度,故b=0。当然此时水中还含有碳酸钠、碳酸钾,而碳酸钠、碳酸钾属于非硬度。图1-18(2)中的这种情况,总碱度大于总硬度,总碱度比总硬度多出的部分称为负硬度,即图中的c=[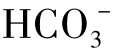 ]-[Ca2+]+[Mg2+],称为负硬度。
]-[Ca2+]+[Mg2+],称为负硬度。
(3)硬度的单位硬度的单位用mmol/L表示最为方便,如果用质量浓度(mg/L)表示,由于硬度并非单一的离子或盐类,必须都换算为一种统一的盐类。此时,可以以CaCO3的浓度表示,如1mmol/L的硬度等于100mg/L的CaCO3。
另外各国常用“度”作为硬度的单位。例如1mmol/L的硬度等于2.8德国度,等于5法国度。一般以“度”表示而未指国名时通常指德国度,各国硬度单位换算见表1-8。
表1-8 各国水的硬度单位比较
(4)天然水的硬度分级天然水中的雨水属软水,地面水的硬度一般不太高,地下水的硬度通常较高。天然水硬度的分级见表1-9。
表1-9 水的硬度分级
相关文章

乳中钙磷等盐类的构成及其状态对乳的物理化学性质有很大影响,乳品加工中盐类的平衡成为重要问题。乳中的铜、铁对储藏中的乳制品有促进其发生异常气味的作用。乳中的矿物质大部分与有机酸和无机酸结合,以可溶性的盐类状态存在。......
2025-09-29

根据《常用危险化学品的分类及标志》的规定,常用危险化学品按危险特性分为26类。(二)根据危险化学品健康危险特性进行分类1.急性毒性指在单剂量或在24h(小时)内多剂量口服或皮肤接触一种物质,或吸入接触4h之后出现的有害效应。吸入毒性包括化学性肺炎、不同程度的肺损伤或吸入后死亡等严重急性效应。......
2025-09-29

(一)蛋壳的化学组成蛋壳为不可食部分,占整个蛋质量的 10%~13%。(二)蛋白(蛋清)的化学组成蛋白(蛋清)是禽蛋的主要组成部分,约占鸡蛋内容物的 64%、鸭蛋内容物的57%、鹅蛋内容物的 62%。表3-1-2黄色蛋黄与白色蛋黄的化学组成(%)蛋白质。卵黄磷蛋白占蛋黄蛋白质总量的 75%~80%,与磷脂结合存在。蛋黄中的色素与饲料有关。......
2025-09-29

由于本章使用的天然气表面张力计算公式是由纯组分的计算公式推导而来的,因此这里首先对后者进行说明。混合物处于平衡态时,界面上存在着最低表面张力或单位面积最小亥姆霍兹自由能的组分的迁移,此现象导致表面张力最大的组分富集在液相,从而气相富集的为表面张力最小的组分。前面提出了计算天然气纯组分表面张力的表达式,此种表达式可以在大温区范围内精确地预测纯组分的表面张力。......
2025-09-29

因为天然水在循环过程中不断地与环境中的各种物质相接触,并且或多或少地溶解它们,所以天然水实际上是一种溶液,并且是成分极其复杂的溶液。天然水的物理化学性质在许多方面与纯水存在不同,例如,天然水的电导率是纯水的数百倍。天然淡水溶质含量低,冰点降低不明显。海水的大多数物理化学性质与0.5mol/kg的食盐水溶液极为相似,假若采用式(1-4)求0.5mol/kg的食盐水的冰点降低,则为-0.93℃。......
2025-09-29

储存条件:储存在阴凉通风的库内,远离火种、热源,避免日光直晒、雨淋、水湿,与氧气、压缩空气及其他危险化学品隔离存放,库温保持在30℃以下。......
2025-09-29

燃烧化学反应最重要的应用是,燃烧气体平衡构成和绝热火焰温度的计算。在实际燃烧反应中,几乎没有燃料与氧化剂直接反应生成燃烧生成物的情况。2分子反应是2个分子的反应,3分子反应是3个分子的反应。这称为化学平衡。......
2025-09-29

纺丝溶液质量控制是纤维生产的重要环节,只有溶解充分、质地均匀的纺丝溶液才有可能获得高质量的纤维。通常11%纺丝溶液的折光率在1.486左右。因此,在生产过程中,当浓度和温度等因素都确定时,监测折光率可以作为纺丝溶液质量控制的重要参数,它一方面可以提供纤维素溶解的状况,另一方面又可以告知NMMO水溶液的浓度。......
2025-09-29
相关推荐